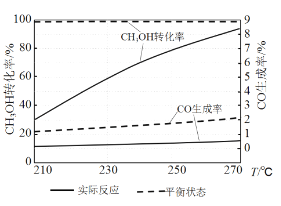
-
化学与社会、生产、生活密切相关。下列说法不正确的是
A. 地沟油可用来生产肥皂、甘油,达到废物利用的目的
B. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
C. 《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。泥土具有吸附作用,能将红糖变白
D. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花不同
难度: 中等查看答案及解析
-
超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。
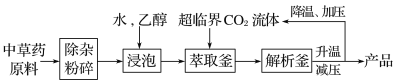
下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
难度: 中等查看答案及解析
-
短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A.R单质和Z单质均可与水发生反应置换出O2
B.上述元素形成的简单离子都能促进水的电离平衡
C.YR6能在氧气中剧烈燃烧
D.元素对应的简单离子的半径: Y>Z>R>X
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得到的结论不正确的是
选项
实验操作和现象
结论
A
向浓度均为0.1mol/L的MgCl2、CuC12混合溶液中逐滴加入氨水,先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
B
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
X不一定具有氧化性
C
某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
不能说明该溶液中一定含有SO42-
D
加热盛有(NH4)2CO3固体的试管,并在试管口放置湿润的红色石蕊试纸,试纸变蓝
(NH4)2CO3显碱性
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
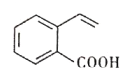
A.1mol 该有机物最多与4molH2反应生成C9H16O2
B.该有机物中所有碳原子不可能处于同一平面上
C.该有机物能发生酯化、加成、氧化、水解等反应
D.与该有机物具有相同官能团的同分异构体有3种
难度: 中等查看答案及解析
-
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是
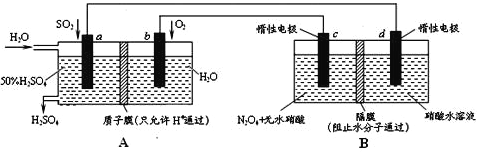
A.电极a和电极c都发生氧化反应
B.电极d的电极反应式为2H++2e-=H2↑
C.c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D.装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
难度: 困难查看答案及解析
-
常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数
(X)随-lgc(OH-) 变化的关系如图所示。下列叙述错误的是
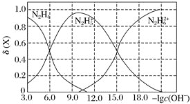
A.Kb1(N2H4)=10-6
B.反应
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
难度: 中等查看答案及解析
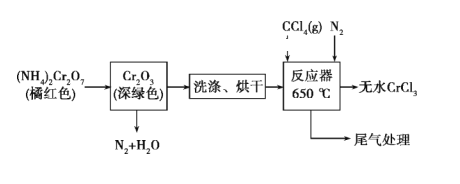
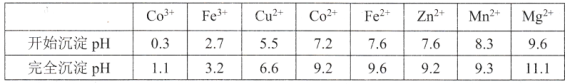
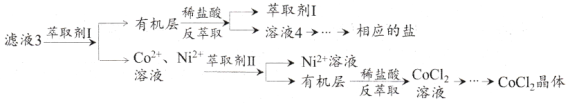
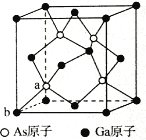
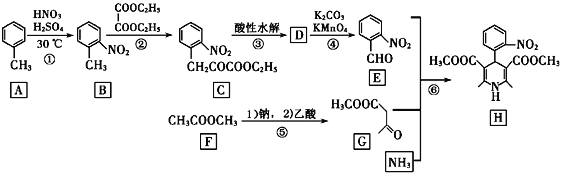
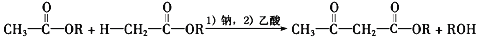
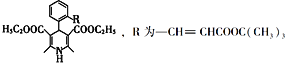 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和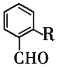 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________