-
下列说法正确的是
A.原电池中,负极上发生的反应是还原反应
B.原电池中,电流的方向是负极−导线−正极
C.双液原电池中的盐桥是为了连通电路,所以也可以用金属导线代替
D.在原电池中,阳离子移向正极,阴离子移向负极
难度: 中等查看答案及解析
-
物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( )
A.KX、KZ、KY B.KX、 KY、KZ
C.KZ、KY 、KX D.KY、KZ、KX
难度: 简单查看答案及解析
-
下列说法正确的是
A.煤的燃烧需要加热点燃,故是吸热反应
B.煅烧石灰石制生石灰是放热反应
C.由C(s,石墨)=C(s,金刚石)△H=+1.9 kJ•mol-1可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
难度: 中等查看答案及解析
-
下列有关能源的说法不正确的是
A.光电转换的基本装置就是太阳能电池,应用相当广泛
B.利用蓝绿藻等低等植物和微生物在阳光作用下可使水分解产生氢气
C.贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D.煤、石油、天然气、氢能中,天然气、氢能是可再生能源
难度: 中等查看答案及解析
-
决定化学反应速率的根本因素是( )
A.温度和压强 B.反应物的浓度 C.反应物的性质 D.催化剂
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
难度: 简单查看答案及解析
-
在一定温度下,可逆反应A(g)+2B(g)
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
难度: 中等查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1<p2 m+n>p放热反应
B.T1>T2 p1<p2 m+n<p吸热反应
C.T1<T2 p1>p2 m+n>p放热反应
D.T1>T2 p1<p2 m+n>p吸热反应
难度: 中等查看答案及解析
-
在氨水中存在下列电离平衡:NH3·H2O
NH4++OH-,下列情况能引起电离平衡向正向移动的有
①加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
难度: 中等查看答案及解析
-
可逆反应2A(g)+3B(g)
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
难度: 中等查看答案及解析
-
化学的实用性表现在它与人们的生活紧密联系。下列常用物质的主要化学成分溶于水后对水的电离有抑制作用的是
A.明矾 B.苏打 C.84 消毒液 D.洁厕灵
难度: 简单查看答案及解析
-
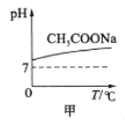
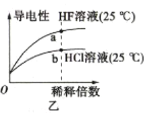
下列图示与对应的叙述相符的是
A.图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B.图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C.图丙表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,曲线d的压强比曲线c的压强大
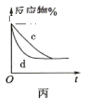
D.图丁表示用0.1000mol·L-1 NaOH溶液滴定20.00mL0.1000mol·L-1 CH3COOH溶液的滴定曲线
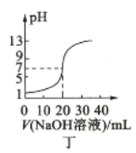
难度: 中等查看答案及解析
-
某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是
A.AgCl的溶解度、Ksp均减小 B.AgCl的溶解度、Ksp均不变
C.AgCl的溶解度减小、Ksp不变 D.AgCl的溶解度不变、Ksp减小
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)> c(OH-)> c(H+)> c(CO32-)
D.0.1 mol·L-1 NH4Cl溶液中:c(NH4+)> c(Cl-) >c(OH-)>c(H+)
难度: 中等查看答案及解析
-
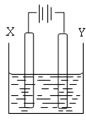
如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
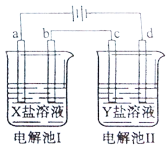
选项
X
Y
A.
CuSO4
AgNO3
B.
AgNO3
NaCl
C.
FeSO4
Al2(SO4)3
D.
MgSO4
CuSO4
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列事实与电化学腐蚀无关的是( )
A.钢铁制品生锈后用盐酸处理
B.黄铜(Cu、Zn合金)制的铜锣不易产生铜绿
C.铜、铝电线一般不连接起来作导线
D.生铁比熟铁(几乎是纯铁)容易生绣
难度: 简单查看答案及解析