-
若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。下列叙述中正确的是( )
A.X元素的气态氢化物的化学式为HX,在常温下很稳定
B.其单质带有金属光泽,具有强氧化性,可与碘化钾发生置换反应生成单质碘
C.其单质的分子式为X2,易溶于有机溶剂
D.AgX是一种有色的易溶于水的化合物
难度: 简单查看答案及解析
-
下列各元素的氧化物中,既能与盐酸反应生成盐和水,又能够与 NaOH 溶液反应生成盐和水的是
A.元素X:它的原子中 M 层比L 层少 2 个电子
B.元素Z:位于元素周期表中的第三周期ⅢA 族
C.元素Y:它的二价阳离子核外电子总数与氩原子相同
D.元素W:它的焰色反应颜色呈紫色
难度: 中等查看答案及解析
-
有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列不正确的是( )
A.M与R的质子数之和一定等于19
B.M、R可能分别处于第二周期和第三周期
C.M、R可能分别处于第三周期和第二周期
D.M和R的质子数之差可能等于7
难度: 中等查看答案及解析
-
ETH天文研究报道称组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne互为同素异形体
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
难度: 简单查看答案及解析
-
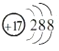
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
难度: 简单查看答案及解析
-
下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为F2+2Cl-=Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易
A. ②③ B. ③④ C. ①④ D. ①②
难度: 简单查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )
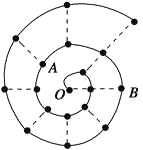
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B组成的化合物中可能含有共价键
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.N2电子式为
B.Cl-的结构示意图为
C.CO2的结构式为O—C—O D.质量数为37的氯原子为
难度: 简单查看答案及解析
-
下列各组顺序的排列不正确的是
A.熔点:金刚石>干冰 B.离子半径:O2-> Na+
C.碱性:KOH > Al(OH)3 D.稳定性:SiH4> H2S
难度: 中等查看答案及解析
-
下列关于化学用语“NH4Cl”的意义,不正确的是( )
A. 氯化铵分子中含有一个NH4+和一个Cl-
B. 氯化铵由N、H、Cl三种元素组成
C. 氯化铵晶体由NH4+和Cl-构成
D. 氯化铵晶体中阴、阳离子个数比为1: 1
难度: 简单查看答案及解析
-
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g·L-1;Y、M、W的最高价氧化物的水化物。两两间都能发生反应。下列说法不正确的是
A.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
B.含有W阳离子的某种盐,可用作净水剂
C.M的单质可保存于煤油中
D.由X、Y、Z 种元素形成的某种化合物的水溶液,可能呈碱性或酸性
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置所示,这四种元素的原子最外层电子数之和是24,下列说法中正确的是
X
Y
Z
W
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性: Z>W
C.四种元素的单质中,W单质的熔、沸点最高
D.X的气态氢化物可与它的最高价氧化物的水化物发生反应
难度: 中等查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径X<W
B. 对应气态氢化物的稳定性Y<Z
C. 化合物XZW既含离子键也含共价键
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
难度: 中等查看答案及解析
-
已知七种短周期元素a~g的有关信息如下表所示:
元素编号
a
b
c
d
e
f
g
原子半径 / nm
0.037
0.074
0.082
0.102
0.143
0.152
0.186
最高化合价或最低化合价
+1
-2
+3
-2
+3
+1
+1
下列推断正确的是
A.氢氧化物碱性的强弱:f < g B.简单离子的离子半径:b < g
C.元素e的氧化物只能与酸反应 D.元素a与元素d形成的化合物属于离子化合物
难度: 中等查看答案及解析