-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是
A.Na2O B.AlCl3 C.FeCl2 D.SiO2
难度: 中等查看答案及解析
-
下列物质属于电解质的是( )
A.Na2O B.SO3 C.Cu D.NaCl溶液
难度: 简单查看答案及解析
-
下列每组物质发生变化所克服的粒子间的作用力属于同种类型的是( )
A.氯化铵受热气化和苯的气化
B.碘和干冰受热升华
C.二氧化硅和生石灰的熔化
D.氯化钠和铁的熔化
难度: 中等查看答案及解析
-
用普通圆底烧瓶将某卤化钠和浓硫酸加热至500℃制备纯净HX气体,则该卤化钠是
A.NaF B.NaCl C.NaBr D.NaI
难度: 中等查看答案及解析
-
下列有关物质性质和应用的因果关系正确的是( )
A.二氧化硫具有漂白性,能使氯水褪色
B.浓硫酸具有较强酸性,能使Cu转化为Cu2+
C.硅具有还原性,一定条件下能将铁从其氧化物中置换出来
D.二氧化锰具有强氧化性,能将双氧水氧化为氧气
难度: 中等查看答案及解析
-
下列各物质或微粒性质的比较中正确的是
A.碳碳键键长:乙烯>苯
B.密度:一氯乙烷>一氯丁烷
C.热稳定性:NaHCO3>Na2CO3>H2CO3
D.沸点:H2O>H2S>H2Se
难度: 中等查看答案及解析
-
根据热化学方程式:S(s)+O2(g)→SO2(g)+297.23kJ,下列说法正确的是
A.1molSO2(g)的能量总和大于1molS(s)和1molO2(g)的能量总和
B.加入合适的催化剂,可增加单位质量的硫燃烧放出的热量
C.S(g)+O2(g)→SO2(g)+Q1 kJ;Q1的值大于297.23
D.足量的硫粉与标况下1升氧气反应生成1升二氧化硫气体时放出297.23 kJ热量
难度: 简单查看答案及解析
-
关于石油和石油化工的说法错误的是
A.石油大体上是由各种碳氢化合物组成的混合物
B.石油分馏得到的各馏分是由各种碳氢化合物组成的混合物
C.石油裂解和裂化的主要目的都是为了得到重要产品乙烯
D.实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油
难度: 简单查看答案及解析
-
下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯净物的是
A.向FeSO4溶液中通入Cl2
B.向KI和NaBr混合溶液中通入Cl2
C.向NaAlO2溶液中加入HCl溶液
D.向NaHCO3溶液中加入Na2O2粉末
难度: 简单查看答案及解析
-
下列叙述中指定粒子数目一定大于NA的是
A.1L1mol/LCH3COOH溶液中所含分子总数
B.1molCl2参加化学反应获得的电子数
C.常温常压下,11.2LN2和NO的混合气体所含的原子数
D.28g铁在反应中作还原剂时,失去电子的数目
难度: 中等查看答案及解析
-
下列有关化学用语或表达正确的是( )
A.三硝酸纤维素脂 B.硬酯酸钠
C.硝基苯的结构简式:
D.NaCl晶体模型:
难度: 中等查看答案及解析
-
加入少许下列一种物质,不能使溴水颜色显著变浅的是
A.Mg粉 B.KOH溶液 C.KI溶液 D.CCl4
难度: 简单查看答案及解析
-
周期表中有如图所示的元素,下列叙述正确的是

A.47.87是丰度最高的钛原子的相对原子质量
B.钛原子的M层上共有10个电子
C.从价电子构型看,钛属于某主族元素
D.22为钛原子的质量数
难度: 简单查看答案及解析
-
下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.活泼非金属单质在氧化还原反应中只作氧化剂
C.阳离子只有氧化性,阴离子只有还原性
D.含有某元素最高价态的化合物不一定具有强氧化性
难度: 中等查看答案及解析
-
下列实验操作或装置(略去部分夹持仪器)正确的是
A.
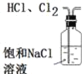 除去HCl中含有的少量Cl2
除去HCl中含有的少量Cl2B.
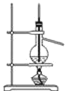 石油的蒸馏
石油的蒸馏C.
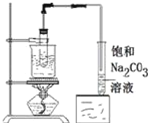 制备乙酸乙酯
制备乙酸乙酯D.
 制备收集干燥的氨气
制备收集干燥的氨气难度: 中等查看答案及解析
-
室温下,对于0.10mol•L﹣1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH﹣═Al(OH)3↓
B.用HNO3溶液完全中和后,溶液不显中性
C.加水稀释后,溶液中c(NH4+)•c(OH﹣)变大
D.1L0.1mol•L﹣1的氨水中有6.02×1022个NH4+
难度: 中等查看答案及解析
-
在通风橱中进行下列实验:
步骤
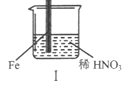
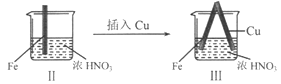
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法不正确的是
A.I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B.II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
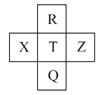
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
难度: 简单查看答案及解析
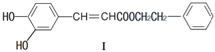

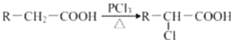 ,A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)(合成路线常用的表示方式为:A
,A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)(合成路线常用的表示方式为:A B…
B…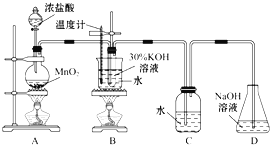
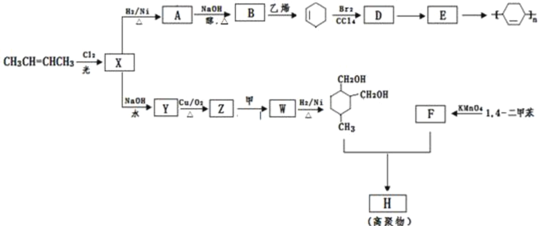
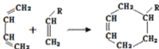 (或写成
(或写成