-
下列各原子或离子的电子排布式错误的是( )
A. K+1s22s22p63s23p6
B. F 1s22s22p5
C. S2-1s22s22p63s23p4
D. Ar 1s22s22p63s23p6
难度: 简单查看答案及解析
-
人们通常将在同一原子轨道上运动、自旋方向相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是
A.1s22s22p63s23p6 B.1s22s22p63s23p63d54s2
C.1s22s22p63s23p63d54s1 D.1s22s22p63s23p63d104s1
难度: 简单查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y小于X
B.气态氢化物的稳定性:HmY小于HnX
C.最高价含氧酸的酸性:X的强于Y的
D.X和Y形成化合物时,X显负价,Y显正价
难度: 简单查看答案及解析
-
下列叙述错误的是( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同( )
A.①③ B.②④ C.②⑤ D.④⑥
难度: 简单查看答案及解析
-
下列对一些实验事实的理论解释正确的是
选项
实验事实
理论解释
A
碘单质在 CCl4 中溶解度比在水中大
CCl4 和 I2 都是非极性分子, 而 H2O 是极性分子
B
CO2 为直线形分子
CO2 分子中 C═O 是极性键
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
HF 的沸点高于 HCl
HF 的相对分子质量小于 HCl
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列表达式正确的是( )
A.基态铬原子Cr的价电子排布式:3d44s2
B.氮原子的L层电子轨道表示式:
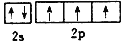
C.K+的结构示意图:
D.HC1O的电子式:
难度: 中等查看答案及解析
-
下列描述中正确的是( )
A.CS2 为空间构型为V形的极性分子
B.双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C.氢原子电子云的一个小黑点表示一个电子
D.HCN、SiF4 的中心原子均为sp3杂化
难度: 简单查看答案及解析
-
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.冰和氯化钾的熔化 D.溴和汞的气化
难度: 简单查看答案及解析
-
下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( )
A.CO2 B.H2O C.CO D.CCl4
难度: 简单查看答案及解析
-
根据价层电子对互斥理论及原子的杂化理论判断PCl3分子的空间构型和中心原子的杂化方式为( )
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
难度: 简单查看答案及解析
-
下列物质的分子中,键角最大的是
A. H2O B. BF3 C. CH4 D. NH3
难度: 中等查看答案及解析
-
图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中b点代表的是( )
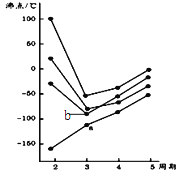
A.H2S B.HCl C.PH3 D.SiH4
难度: 中等查看答案及解析
-
向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是
A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3] C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
难度: 中等查看答案及解析
-
下列物质的性质与氢键无关的是( )
A.冰的密度比水的密度小 B.氨气极易溶于水
C.AsH3的沸点比PH3的高 D.溶解度:邻羟基苯甲醛<对羟基苯甲醛
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.C2H6中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为
难度: 简单查看答案及解析
-
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是 ( )
A.C3N4晶体是分子晶体
B.C3N4晶体中C—N键的键长比金刚石中的C—C键的键长短
C.C3N4晶体中C、N原子个数之比为4∶3
D.C3N4晶体中微粒间通过离子键结合
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是( )
A.电负性:④>③>②>①
B.原子半径:④>③>②>①
C.第一电离能:④>③>②>①
D.最高正化合价:④>③=②>①
难度: 简单查看答案及解析
-
根据表中信息,下列叙述正确的是( )
短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.089
0.104
0.066
主要化合价
+2
+3
+2
+6、﹣2
﹣2
A.氢化物的热稳定性:H2T<H2R
B.单质与稀盐酸反应的速率:L<Q
C.离子半径:R2﹣<L2+
D.M与T形成的化合物既能与强酸反应,又能与强碱反应
难度: 简单查看答案及解析
-
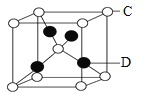
某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( )

A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
难度: 简单查看答案及解析
-
下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6
A.①②③ B.②③④
C.④⑤ D.②③⑥
难度: 简单查看答案及解析
-
关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是
A.配位体是Cl﹣和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl﹣的数目比是1:2
D.加入足量AgNO3溶液,所有Cl﹣均被完全沉淀
难度: 中等查看答案及解析
-
以下有关元素性质的说法不正确的是
A.具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4电负性最大的是③
B.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的第一电离能随原子序数增大而递增的是④
D.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是①
难度: 中等查看答案及解析
-
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
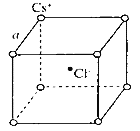
A.
g· cm-3 B.
g· cm-3
C.
g· cm-3 D.
g· cm-3
难度: 中等查看答案及解析
-
锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )
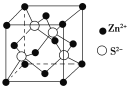
A.该晶体属于分子晶体
B.该晶胞中Zn2+和S2-数目不相等
C.阳离子的配位数为6
D.氧化锌的晶格能大于硫化锌
难度: 简单查看答案及解析
-
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为−2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
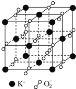
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧与−2价氧的数目比为2:1
难度: 中等查看答案及解析