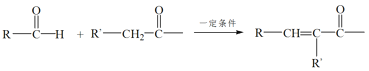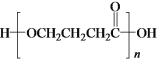-
化学让世界更美好,下列物质在生活中应用时,起还原作用的是( )




A.明矾用作净水剂
B.甘油用作护肤保湿剂
C.漂粉精用作消毒剂
D.铁粉用作食品脱氧剂
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
反应NH4Cl+NaNO2==NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语不正确的是( )
A.中子数为18的氯原子:
Cl B.N2的电子式:
C.Na+的结构示意图:
D.H2O分子的比例模型:
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.可用碘水检验淀粉在酸性条件下水解是否完全
B.工业上可用淀粉、纤维素为原料生产葡萄糖
C.疫苗要冷冻保藏,以防止蛋白质变性
D.油脂的氢化、葡萄糖的银镜反应均属于氧化反应
难度: 简单查看答案及解析
-
一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法不正确的是( )
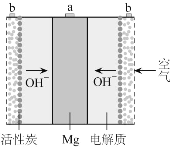
A.电池总反应式为:2Mg+ O2+2H2O=2Mg(OH)2
B.正极反应式为:Mg-2e-=Mg2+
C.活性炭可以加快O2在电极上的反应速率
D.电子的移动方向由a经外电路到b
难度: 中等查看答案及解析
-
Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2
B.Na2CO3溶液呈碱性:CO32-+H2O
H2CO3+2OH-
C.NaHCO3可作发酵粉:2NaHCO3
Na2CO3+CO2↑ +H2O
D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
卡拉诺利是一种抗HIV药物,其结构简式如图所示,下列关于卡拉诺利的说法正确的是( )
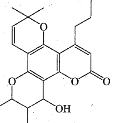
A.该物质属于苯的同系物
B.该物质遇FeCl3溶液显色
C.分子中有3种含氧官能团
D.1mol该物质与足量NaOH溶液反应时消耗1molNaOH
难度: 中等查看答案及解析
-
下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号
A
B
C
D
实验
方案
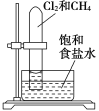
置于光亮处
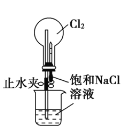
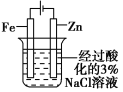
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液
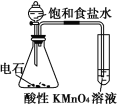
实验
目的
验证甲烷与氯气发生化学反应
进行喷泉实验
验证Fe电极被保护
验证乙炔的还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
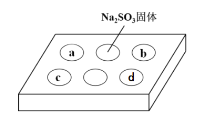
序号
试剂
实验现象
a
品红溶液
红色褪去
b
酸性KMnO4溶液
紫色褪去
c
NaOH溶液(含2滴酚酞)
红色褪去
d
H2S溶液
黄色浑浊
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性
难度: 中等查看答案及解析
-
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
、
、
分别表示N2、H2、NH3,已知:N2(g)+3H2(g)
2NH3(g) ΔH=-92kJ·mol-1
下列说法正确的是( )
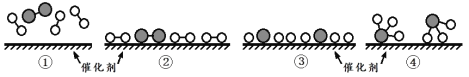
A.使用催化剂,合成氨反应放出的热量减少
B.②→③过程,是吸热过程且只有H-H键的断裂
C.③→④过程,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
难度: 简单查看答案及解析
-
室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加amL0.1mol/L稀盐酸,至溶液的pH=7。
下列说法正确的是
A.①中溶液的pH=1
B.②中反应后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反应后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
难度: 中等查看答案及解析
-
2019年为“国际化学元素周期表年”。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是( )
A.原子半径:W<X
B.X的最高价氧化物的水化物是强碱
C.Y单质可用做半导体材料
D.气态氢化物热稳定性:Z<W
难度: 中等查看答案及解析
-
某种用于隐形眼镜材料的聚合物片段如下:
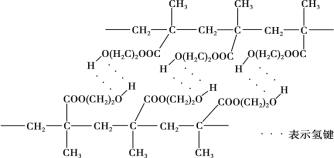
下列关于该高分子说法正确的是( )
A.结构简式可以表示为:
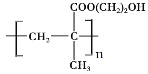
B.氢键对该高分子的性能没有影响
C.合成该高分子的反应为缩聚反应
D.单体具有4种不同化学环境的氢原子
难度: 中等查看答案及解析
-
亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
难度: 简单查看答案及解析
-
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
I
II
III
实验
步骤
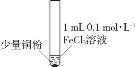
充分振荡,加2mL蒸馏水
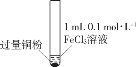
充分振荡,加入2mL蒸馏水
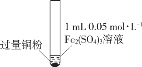
充分振荡,加入2mL蒸馏水
实验
现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
难度: 中等查看答案及解析
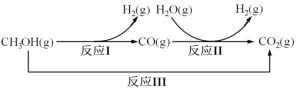

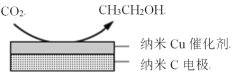
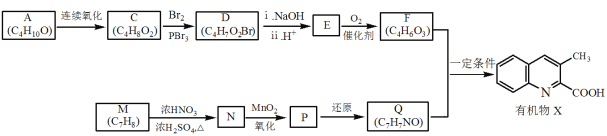
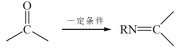 +H2O
+H2O