-
物质发生化学变化时,下列认识错误的是
A.一定有新的物质生成 B.必然发生旧化学键断裂,新化学键形成
C.原子的数目可能有变化 D.必然伴随着能量的变化
难度: 简单查看答案及解析
-
氢氧化钠溶于水,溶液温度显著升高的原因是
A.氢氧化钠溶于水只发生扩散作用
B.氢氧化钠溶于水只发生水合作用
C.氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量
D.氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量
难度: 简单查看答案及解析
-
下列表达方式错误的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
将Cl2制成漂粉精的主要目的是
A.使它转化为较稳定物质,便于保存和运输
B.增强漂白和消毒作用
C.使它转化为较易溶于水的物质
D.增加氯的质量分数,有利于漂白、消毒
难度: 中等查看答案及解析
-
卤族元素随着原子核电荷数的增加,下列叙述不正确的是
A.原子半径依次增大 B.单质的熔沸点逐渐升高
C.卤离子的还原性逐渐减弱 D.氢化物的热稳定性依次减弱
难度: 中等查看答案及解析
-
下列变化需要加入还原剂才能实现的是 ( )
A.KClO3→O2 B.HCl→Cl2 C.Fe→Fe3+ D.MnO4-→Mn2+
难度: 简单查看答案及解析
-
已知下列反应式,(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br-则离子中,还原性由强到弱的排列顺序正确的是
A.Br->Fe2+>I- B.I->Fe2+>Br- C.Br->I->Fe2+ D.Fe2+>I->Br-
难度: 中等查看答案及解析
-
下表列出的有关表述中不准确的是
序号
A
B
C
D
物质类型
离子化合物
共价键直接构成的物质
共价分子
稀有气体
代表物质
NaCl
金刚石
干冰
Ne
组成晶体的结构微粒
Na+、Cl-
C
CO2
Ne
结构微粒间相互作用
离子键
共价键
分子间作用力
共价键
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列物质只能作还原剂的是
A.S2- B.Fe2+ C.Fe3+ D.H+
难度: 简单查看答案及解析
-
下列说法不正确的是
A.物质燃烧总是放热的
B.放热反应在反应发生时都不需要加热
C.热化学方程式中,化学式前的化学计量数仅表示物质的量
D.大多数化合反应是放热的,大多数分解反应是吸热的
难度: 中等查看答案及解析
-
下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g)+270KJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270KJ
D.该反应过程的能量变化可用图来表示
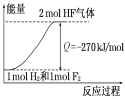
难度: 中等查看答案及解析
-
高中化学学习过程中的物质颜色是需要注意的。下列关于颜色的描述正确的个数是
① 氯水放久了会逐渐由黄绿色变成几乎无色
② AgBr见光分解会生成浅黄色的银
③ KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,CCl4层紫红色
⑤氢气能在氯气中燃烧,火焰为黄色
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
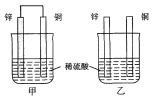
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.甲装置的导线中有电流,电流方向为锌→铜
难度: 中等查看答案及解析
-
用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出 B.样品中含有少量Na2O杂质
C.容量瓶使用前未干 D.定容时仰视液面
难度: 中等查看答案及解析
-
甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加乙溶液,颜色无明显变化。则甲、乙、丙依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
难度: 中等查看答案及解析
-
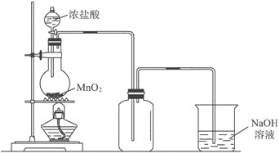
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气
L
B.NA可表示为:
C.反应后溶液中的Cl―数目为:
D.反应后溶液中的H+数目为:
难度: 中等查看答案及解析
-
把含有某一氯化物杂质的氯化钙5.55克溶于水后,与足量的硝酸银溶液反应,生成的氯化银沉淀15克,则该杂质可能是
A.氯化钠 B.氯化钾
C.氯化铜 D.氯化铝
难度: 困难查看答案及解析