-
同温同压下,1 mol H2和1 mol O2,下列有关它们的说法正确的是
A. 质量相同,体积不同 B. 分子数相同,质量不同
C. 体积相同,分子数不同 D. 体积相同,原子数不同
难度: 简单查看答案及解析
-
某溶液中含有较大量的Cl-、CO32-、OH-3种阴离子,如果只取一次该溶液就能分别将3种阴离子依次检验出来,下列实验操作顺序(滴加的试剂均过量)正确的是( )
①滴加Mg(NO3)2溶液; ②过滤; ③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③ B.①②③②④ C.④②①②③ D.④②③②①
难度: 中等查看答案及解析
-
下列实验过程中出现的异常情况,其可能原因分析错误的是
选项
异常情况
可能原因分析
A
蒸发结晶:蒸发皿破裂
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部
B
分液:分液漏斗中的液体难以滴下
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐
C
蒸馏:冷凝管破裂
冷凝管没有通水或先加热后通水
D
萃取:液体静置不分层
加入萃取剂的量较多
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法正确的是
A. 摩尔既是物质的量的单位,又是粒子的数量单位
B. 2 mol O2的摩尔质量是64 g/mol
C. 当摩尔质量以g·mol-1为单位时,在数值上与阿伏加德罗常数个该物质的微粒的质量总和相等(质量以g为单位)
D. 1 mol SO2中含有2 mol氧元素
难度: 中等查看答案及解析
-
下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥蒸发 ⑦配制一定浓度的溶液,一定要用到玻璃棒的是
A.①②④⑥ B.①②③⑥ C.①②⑥⑦ D.①④⑤⑥
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
C.常温常压下,NA个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol•L-1的MgCl2溶液中含有Cl﹣个数为NA
难度: 简单查看答案及解析
-
下列关于物质的量浓度表述不正确的是
A. 0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的物质的量之比为2:1
B. 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C. 在通常情况下,22.4L的氯化氢气体中含有的HCl分子数小于NA
D. 10 ℃时,0.35 mol·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
难度: 中等查看答案及解析
-
实验室里需要480 mL 0.1mol/L的硫酸铜溶液,选取容量瓶进行配制,以下操作正确的是[胆矾(CuSO4·5H2O)]
A. 称取7.68 g硫酸铜,加入500 mL水 B. 称取12.0 g胆矾配成500 mL溶液
C. 称取8.0 g硫酸铜,加入500 mL水 D. 称取12.5 g胆矾配成500 mL溶液
难度: 中等查看答案及解析
-
科学家刚刚发现了某种元素的原子,其质量是ag,一个12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.该原子的摩尔质量是aNAg/mol
B.Wg该原子的物质的量是
mol
C.该原子的相对原子质量为
D.由已知信息可得NA=
难度: 中等查看答案及解析
-
将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(p)与温度(T)的关系如图所示,则X、Y气体分别可能是
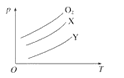
A.C2H4、CH4 B.CO2、Cl2 C.SO2、CO2 D.CH4、Cl2
难度: 简单查看答案及解析
-
若20g密度为ρg·cm-3的Ca(NO3)2溶液里含1gCa2+,则NO的物质的量浓度是(mol·L-1)
A.
B.
C.2.5ρ D.1.25ρ
难度: 中等查看答案及解析
-
为了配制100 mL 1 mol/L NaOH 溶液,其中有下列几种操作,错误的操作是()。
①选刚用蒸馏水洗净过的100 mL 容量瓶进行配制
②NaOH 固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切
⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出超过的一部分
A.①③⑤ B.①④⑤ C.②④⑤ D.③④⑤
难度: 简单查看答案及解析
-
VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.
mol/L B.
mol/L
C.
mol/L D.
Vmol/L
难度: 中等查看答案及解析
-
把500
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 同温同压下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1
难度: 困难查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.
B.
C.
D.
=1000Vρ/(17V+22400)
难度: 困难查看答案及解析
-
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是
A.右边CO和CO2分子数之比为1:3
B.右边CO的质量为14g
C.右边气体密度是相同条件下氧气密度的2倍
D.若改变右边CO和CO2的充入量而使隔板处于距离右端1/3 处,若保持温度不变,则前后两次容器内的压强之比为5:6
难度: 中等查看答案及解析

