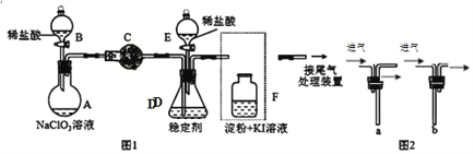
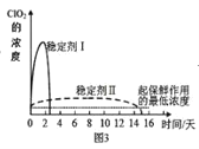
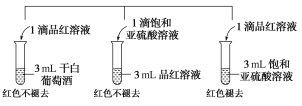
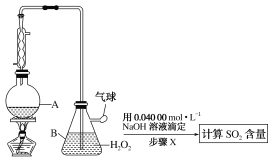
-
某稀溶液中含有4molKNO3和2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3-被还原为NO)。下列说法正确的是( )
A.反应后生成NO的体积为28L
B.所得溶液中c(Fe2+):c(Fe3+)=1:1
C.所得溶液中c(NO3-)=2.75mol/L
D.所得溶液中的溶质只有FeSO4
难度: 中等查看答案及解析
-
有氯气参加的化学反应一定不属于
A.复分解反应 B.置换反应 C.取代反应 D.加成反应
难度: 中等查看答案及解析
-
下列实验事实不能用基团间相互作用来解释的是
A.与Na反应时,乙醇的反应速率比水慢
B.苯酚能与NaOH溶液反应而乙醇不能
C.乙醇能使重铬酸钾溶液褪色而乙酸不能
D.苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低
难度: 中等查看答案及解析
-
天然气脱硫的方法有多种,一种是干法脱硫,其涉及的反应:H2(g)+CO(g)+SO2(g)
H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是
A.加催化剂 B.分离出硫 C.减压 D.加生石灰
难度: 简单查看答案及解析
-
根据下图,下列判断中正确的是
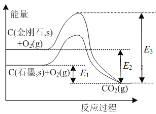
A.石墨与O2生成CO2的反应是吸热反应
B.等量金刚石和石墨完全燃烧,金刚石放出热量更多
C.从能量角度看,金刚石比石墨更稳定
D.C(金刚石,s) = C(石墨,s) + Q kJ Q= E3—E2
难度: 中等查看答案及解析
-
向H2S的水溶液中通入一定量的Cl2,下列图像所示变化正确的是
A.
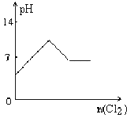 B.
B.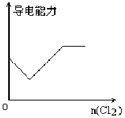 C.
C.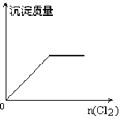 D.
D.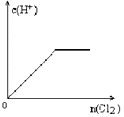
难度: 中等查看答案及解析
-
下列物质中,既能发生取代反应,又能发生消去反应,同时催化氧化生成醛的是( )
A.
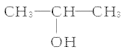 B.
B.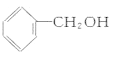
C.
D.

难度: 中等查看答案及解析
-
钙和钠相似,也能形成过氧化物,则下列叙述正确的是
A.过氧化钙的化学式是Ca2O2
B.1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气
C.过氧化钙中阴阳离子数之比为2:1
D.过氧化钙中只含离子键
难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
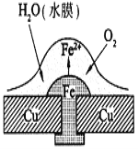
A.正极电极反应式为:2H++2e—→H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
难度: 简单查看答案及解析
-
某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:

下列说法不正确的是( )
A.x为NaOH溶液,y为盐酸
B.a→b发生的反应为:AlO2-+H++H2O═Al(OH)3↓
C.b→c→Al的反应条件分别为:加热、电解
D.a、b、c既能与酸又能与碱反应
难度: 中等查看答案及解析
-
用如图装置进行实验,下列预期实验现象及相应结论均正确的是( )
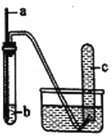
a
b
预期实验现象
结论
A
铜丝
浓硝酸
试管c中有大量红
棕色气体
浓硝酸有强氧化性
B
木条
18.4mol·L-1硫酸
木条下端变黑
浓硫酸有酸性和氧化性
C
生铁
NaCl溶液
导管处发生水倒吸
生铁发生吸氧腐蚀
D
铁丝
含少量HCl的H2O2
溶液
试管c中有大量无色气体
该反应中铁作催化剂
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:
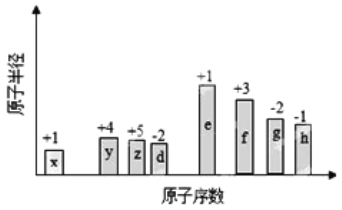
下列说法正确的是
A.离子半径的大小顺序:e>f>g>h
B.与x形成简单化合物的沸点:y>z>d
C.x、z、d三种元素形成的化合物可能含有离子键
D.e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
难度: 中等查看答案及解析
-
在加热固体NH4Al(SO4)2•12H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4)3,下列判断正确的是( )
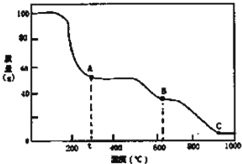
A.0℃→t℃的过程变化是物理变化
B.C点物质是工业上冶炼铝的原料
C.A→B反应中生成物只有Al2(SO4)3和NH3两种
D.Al2(SO4)3能够净水,其原理为:Al3++3OH-
Al(OH)3
难度: 中等查看答案及解析
-
常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
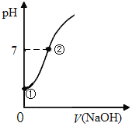
A.①点所示溶液中只存在HClO的电离平衡
B.①到②水的电离程度逐渐减小
C.I-能在②点所示溶液中存在
D.②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
难度: 中等查看答案及解析
-
化学与日常生活紧密相关。下列说法中,不正确的是
A.甲醛可作食品防腐剂 B.氢氧化铝可作抗酸药
C.氯化钠可作食品调味剂 D.生石灰可作食品干燥剂
难度: 简单查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法正确的是
A.氘(D)的原子核外有2个电子 B.1H与D是同一种原子
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
难度: 中等查看答案及解析
-
下列有关氮元素及其化合物的表示正确的是( )
A.质子数为7、中子数为8的氮原子:
N
B.溴化铵的电子式:
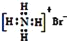
C.氮原子的结构示意图:
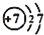
D.间硝基甲苯的结构简式:
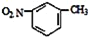
难度: 简单查看答案及解析
-
碘晶体升华时,下列所述内容发生改变的是
A.分子内共价键 B.分子间的作用力
C.碘分子的大小 D.分子内共价键的键长
难度: 中等查看答案及解析
-
下列物质的熔点,前者大于后者的是
A.晶体硅、碳化硅 B.氯化钠、甲苯 C.氧化钠、氧化镁 D.钾钠合金、钠
难度: 简单查看答案及解析

 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成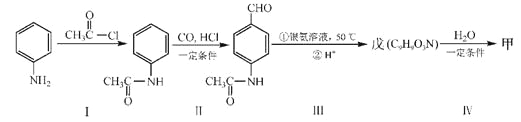

 CH3CH2OH
CH3CH2OH  CH3COOCH2CH3___
CH3COOCH2CH3___