-
25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)===Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是( )
A. 若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大
B. 若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色
C. 若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动
D. 若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大
难度: 困难查看答案及解析
-
下列表述中,与盐类水解有关的是
①明矾和FeCl3可作净水剂;
②为保存FeCl3溶液,要在溶液中加少量盐酸;
③AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂;
⑤实验室盛放NaOH溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
⑦草木灰与铵态氮肥不能混合施用。
A.①②③⑤⑥⑦ B.①②③④⑥⑦
C.①③⑤⑥⑦ D.①④⑤⑦
难度: 中等查看答案及解析
-
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O
H3O++CO32-
B.CH3COO-+H2O
CH3COOH+OH-
C.PO43-+H3O+
HPO42-+H2O
D.H2O+H2O
H3O++OH-
难度: 简单查看答案及解析
-
pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
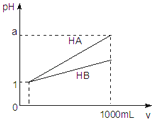
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.pH相同的HA、HB溶液,物质的量浓度HA<HB
C.若1<a<4,则HA、HB都是弱酸
D.体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
难度: 中等查看答案及解析
-
用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是( )
①锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次
②滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失
③滴定前读数时仰视,滴定后读数平视
④摇动锥形瓶时,瓶中有少量液体溅出
⑤滴定时,锥形瓶中加入少量蒸馏水,稀释待测液
⑥盛放标准液的滴定管水洗后没有润洗
A.①②③ B.①④⑤
C.①②⑥ D.②③④
难度: 简单查看答案及解析
-
下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是
A.各常数的大小与温度有关
B.各常数的大小说明平衡体系正反应的程度大小
C.若温度升高则各常数一定增大
D.化学平衡常数越大反应物平衡转化率越大
难度: 中等查看答案及解析
-
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
A.
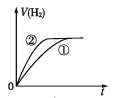 B.
B.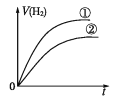
C.
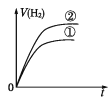 D.
D.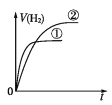
难度: 简单查看答案及解析
-
液氨与水的性质相似,也存在微弱电离:2NH3(l)
NH4++NH2-,其离子积常数K=c(NH4+)·c (NH2-)=2×10-30(223K),维持温度不变,向液氨中加入少量NH4Cl 固体,不发生改变的是
A.液氨的电离程度 B.液氨的离子积常数
C.c(NH4+) D.c(NH2-)
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中
减小
C.醋酸的电离程度增大,c(H+)也增大
D.溶液中
增大
难度: 中等查看答案及解析
-
若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为( )
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
难度: 中等查看答案及解析
-
下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7;②用HF溶液做导电性实验,灯泡很暗;③等物质的量浓度的HCl溶液和HF溶液与足量锌粒反应,刚开始HCl溶液产生的气泡快;④常温下0.1mol/L的HF溶液pH为2.3;⑤HF能与Na2CO3溶液反应,产生CO2气体;⑥HF与水能以任意比混溶;⑦1mol/L的HF水溶液能使紫色石蕊试液变红;⑧pH=3的HF溶液稀释至原体积的10倍,pH值减小0.6;⑨等物质的量浓度的HCl溶液和HF溶液与足量锌粒反应,产生氢气的量一样多
A.①③④ B.①②③④⑤⑧ C.②④⑧⑨ D.①②⑦⑧
难度: 中等查看答案及解析
-
在常温下,pH=9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH─离子浓度分别为M和N,则M与N的关系为( )
A.M>N B.M=10﹣4N C.N=10﹣4M D.M=N
难度: 简单查看答案及解析
-
下列物质的水溶液在空气中加热蒸干至质量不再减少,能得到较纯净的原溶质的是( )
①CuSO4;②FeSO4;③K2CO3;④Ca(HCO3)2;⑤NH4HCO3;⑥KMnO4;⑦FeCl3
A.全部 B.仅①② C.仅①⑤ D.仅①③
难度: 困难查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.100mol•L﹣1的NaOH溶液滴定体积均为10.00mL、浓度均为0.100mol•L﹣1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
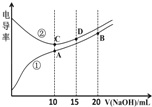
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO﹣)+c(OH﹣)﹣c(H+)=0.05mol•L﹣1
C.在相同温度下,A、B、C三点溶液中水的电离程度: B<A=C
D.D点溶液中:c(Cl﹣)=2c(OH﹣)﹣2c(H+)
难度: 困难查看答案及解析
-
下列实验的反应原理及对应的离子方程式均正确的是( )
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2O⇌NH3•H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣═2AlO2﹣+H2↑
C.Na2CO3溶液呈碱性的原因:
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
难度: 中等查看答案及解析
-
在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项
条件
离子组
离子共存判断及离子方程式
A
滴加氨水
Na+、Fe3+、Cl﹣、NO3﹣
不能大量共存
Fe3++3OH-=Fe(OH)3↓
B
由水电离出的c(H+)=1×10﹣13 mol•L﹣1
K+、NH4+、Cl﹣、AlO2﹣
能大量共存
C
pH=1的溶液
Fe3+、NH4+、I﹣、SO42﹣
不能大量共存,2Fe3++2I﹣═2Fe2++I2
D
通入少量SO2气体
K+、Na+、ClO﹣、SO42﹣
不能大量共存,2ClO﹣+SO2+H2O═2HClO+SO32﹣
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl
AgI
Ag2S
Ksp
1.8×10−10
8.3×10−17
6.3×10−50
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
难度: 中等查看答案及解析
-
下列有关溶液中粒子浓度的说法不正确的是
A.0.1mol·L-1NaHCO3溶液:c(Na+)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.Na2S稀溶液:c(H+)=c(OH-)-2c(H2S)-c(HS-)
C.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
难度: 中等查看答案及解析
-
常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
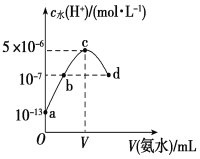
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
难度: 中等查看答案及解析
-
活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图:
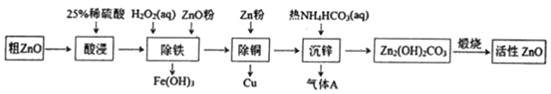
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
开始沉淀
5.4
7.0
2.3
4.7
完全沉淀
8.0
9.0
4.1
6.7
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
难度: 中等查看答案及解析