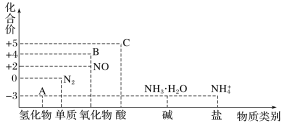
-
下列叙述不正确的是( )
A. 氨易液化,液氨常用作制冷剂
B. 与金属反应时,稀硝酸可能被还原为更低价态,稀硝酸氧化性强于浓硝酸
C. 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D. 稀硝酸和活泼金属反应时得不到氢气
难度: 简单查看答案及解析
-
下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成NO2 ②铵盐都不稳定,受热分解都生成氨气 ③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 ④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
A. ①③④ B. ①③
C. ①④ D. ①②③④
难度: 中等查看答案及解析
-
在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )
A.钛合金 B.二氧化硅 C.晶体硅 D.氧化铝
难度: 简单查看答案及解析
-
如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
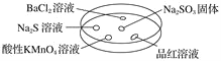
下表中对实验现象的描述或所做的解释不正确的是( )
选项
实验现象
解释
A
BaCl2溶液变浑浊
SO2与BaCl2溶液反应产生了BaSO3沉淀
B
Na2S溶液变浑浊
SO2与Na2S溶液反应产生了S单质
C
酸性KMnO4溶液褪色
SO2具有还原性
D
品红溶液褪色
SO2具有漂白性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
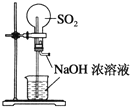
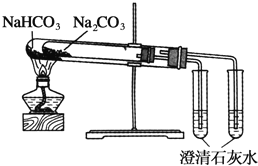
下列实验装置不能达到实验目的的是( )
A.用SO2做喷泉实验
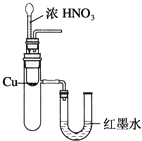
B.验证Cu与浓硝酸反应的热量变化
C.验证NH3易溶于水
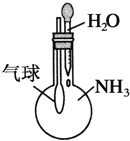
D.比较Na2CO3与NaHCO3的稳定性
难度: 中等查看答案及解析
-
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
难度: 中等查看答案及解析
-
某小组为研究原电池原理,设计如图装置。下列叙述不正确的是( )
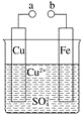
A.无论a和b是否连接均可形成原电池
B.a和b不连接时,铁片上会有金属铜析出
C.a和b用导线连接时,铜片上发生的反应为Cu2++2e-= Cu
D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
难度: 简单查看答案及解析
-
某反应由两步反应A
B
C构成,它的反应能量曲线如图,下列叙述正确的是( )
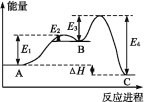
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.A与C的能量差为E4
D.A
B的反应,反应条件一定要加热
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,正确是( )
A.保持压强不变,充入少量氦气,反应速率会减小
B.若v(CO)=v(H2O),则反应达平衡状态
C.其他条件不变,适当增加C(s)的质量会使反应速率增大
D.其他条件不变,仅将容器的体积缩小一半,反应速率减小
难度: 中等查看答案及解析
-
某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )。
A.用铜片、铅笔芯作电极插入稀硫酸中
B.用两个铜片作电极插入硝酸银溶液中
C.用锌片、铜片作电极插入番茄中
D.用铜片、铁片作电极插入酒精中
难度: 简单查看答案及解析
-
可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是( )
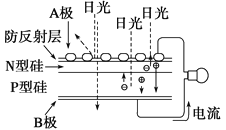
A.如上图是太阳能光伏发电原理图,图中A极为正极
B.风能、太阳能、生物质能等属于可再生能源
C.推广可再生能源有利于经济可持续发展
D.光伏发电能量转化方式是太阳能直接转变为电能
难度: 简单查看答案及解析