-
东汉蔡伦总结前人经验,用树皮、破渔网、破布、麻头等作为原料,制造成较低成本的书写纸,史称“蔡侯纸”。“蔡侯纸”的主要成分可能是( )
A.淀粉 B.天然纤维
C.聚氯乙烯 D.二氧化硅
难度: 简单查看答案及解析
-
下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向发黄的浓硝酸中通入O2
黄色褪去
浓硝酸中混有Fe3+
B
向无色溶液中滴加FeCl3溶液和CCl4,振荡、静置
下层显紫红色
原溶液中含有I-
C
向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液
紫红色褪去
乙醇发生了消去反应
D
向浓度均为0.1mol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分子式为C9H10O2,且分子结构中含苯环,苯环上有两个取代基,其中一个取代基为甲基,另外一个取代基中含有
结构的同分异构体(不考虑立体异构)共有( )
A.3种 B.6种 C.9种 D.12种
难度: 中等查看答案及解析
-
H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是
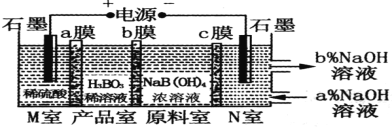
A.M室发生的电极反应式为:2H2O-4e- =O2↑+4H+
B.N室中:a%<b%
C.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D.理论上每生成1mol产品,阴极室可生成标准状况下5.6 L气体
难度: 困难查看答案及解析
-
25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
CH3COONa
pH
7.0
7.0
8.1
8.9
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等
难度: 中等查看答案及解析
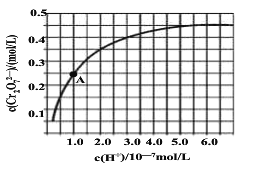
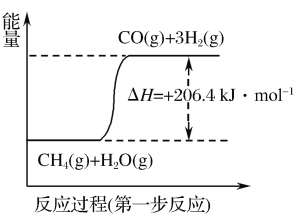
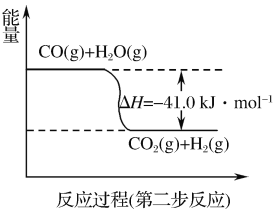
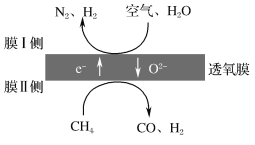

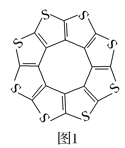
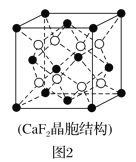
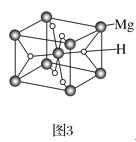
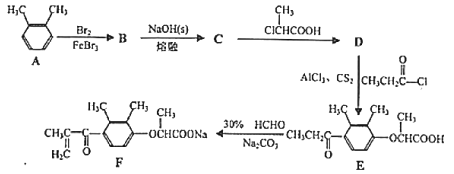
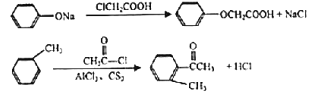
 )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以