-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
A. 缤纷绚丽的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
B. 为消除碘缺乏病政府规定在食盐中必须添加一定量的KI
C. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中装还原铁粉
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
难度: 简单查看答案及解析
-
2019年诺贝尔化学奖颁给几位在锂离子电池研发领域做出贡献的科学家,锂单质化学性质与钠类似,活泼性比钠略差。它的密度为0.534g/cm3,锂元素的焰色为紫红色,将绿豆大的锂投入水中,下列实验现象合理的有( )
①锂沉入水中 ②锂浮在水面上 ③水中有大量气泡 ④反应后在水中加入几滴石蕊试液,溶液变红 ⑤反应剧烈,发出紫红色火焰 ⑥锂四处游动
A.②⑥ B.①③ C.②③⑤ D.②④⑤⑥
难度: 简单查看答案及解析
-
某稀溶液中含有4molKNO3和2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3-被还原为NO)。下列说法正确的是( )
A.反应后生成NO的体积为28L
B.所得溶液中c(Fe2+):c(Fe3+)=1:1
C.所得溶液中c(NO3-)=2.75mol/L
D.所得溶液中的溶质只有FeSO4
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法正确的是
A.淀粉溶液、豆浆、雾和饱和食盐水均可发生丁达尔现象
B.氮化硅(Si3N4)、氧化铝(Al2O3)、碳化硅(SiC)和二氧化锆(ZrO2)都可用作制高温结构陶瓷的材料
C.绿色化学的核心是利用化学原理治理环境污染
D.光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值,下列有关叙述正确的是()
A.将78gNa2O2与过量CO2反应转移的电子数为2NA
B.1molN2与4molH2反应生成的NH3分子数为2NA
C.标准状况下,2.24LSO3中所含原子数为0.4NA
D.标准状况下,18gD2O中所含电子数为9NA
难度: 中等查看答案及解析
-
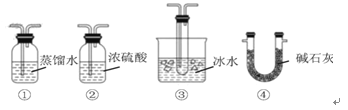
实验室制取少量干燥的氨气涉及下列装置,其中正确的是:
A.①是氨气发生装置
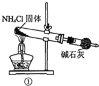
B.②是氨气吸收装置

C.③是氨气发生装置

D.④是氨气收集、检验装置

难度: 中等查看答案及解析
-
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓ + S4O62- + 2H2O 。下列说法不正确的是
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C.每生成1 molFe3O4 ,反应转移的电子为4 mol
D.O2是氧化剂,S2O32-与Fe2+是还原剂
难度: 中等查看答案及解析
-
硼有两种天然同位素
、
B,硼元素的近似相对原子质量为10.80,则对硼元素中
的质量分数判断正确的是( )
A.20% B.略大于20% C.略小于20% D.80%
难度: 简单查看答案及解析
-
单质及其化合物的转化关系是化学学习的重要内容之一.下列各组物质的转化关系中能通过一步反应完成的是()
A.Si→SiO2→H2SiO3→Na2SiO3
B.Fe→Fe(OH)3→Fe2O3→Fe(NO3)3
C.HCl→Cl2→HClO→NaClO
D.Al→Al2O3→Al(OH)3→AlCl3
难度: 中等查看答案及解析
-
下列说法不正确的有几个()
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③18gH2O中含有的中子数为10NA
④标准状况下,等体积CH4和HF所含的分子数相同
⑤通过化学变化可以实现
与
之间的相互转化
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
下列各组离子在指定条件下能大量共存的是()
A.无色透明的酸性溶液:Cl-、Na+、MnO4−、SO42−
B.酸性溶液:Na+、NH4+、K+、CO32−
C.加入过量NaOH溶液后可得到澄清溶液:K+、Ba2+、HCO3−、Cl-
D.澄清透明溶液中:Fe2+、Na+、SO42−、Cl-
难度: 简单查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加稀NaOH溶液,将红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
B
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
C
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
D
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年1月3日10时26分,嫦娥四号探测器实现人类探测器首次月背软着陆。月背探测器用的是同位素温差发动机,使用的放射性同位素有
(锶)、
(钚)、
(钋)。通过衰变产生能量发电。下列有关同位素的说法中正确的是()
A.位于周期表中同一周期同一族的不同的核素,一定互为同位素
B.氧有三种核素16O、17O、18O,所以自然界中的氧气分子共有6种
C.同位素是指质子数相同中子数不同的微粒间的互称
D.温差发动机使用时没有发生化学变化
难度: 简单查看答案及解析
-
己知氧化性:Cl2>Br2>Fe3+>I2,判断下列化学方程式一定不正确的是
A.2FeCl3+2KI→2FeCl2+2KCl+I2 B.6FeCl2+3Br2→4FeCl3+2FeBr3
C.FeBr2+Cl2→FeCl2+Br2 D.FeI2+Cl2→FeCl2+I2
难度: 简单查看答案及解析
-
某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42- 等五种阴离子,向其中加入少量的过氧化钠固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )
A.① B.①⑤ C.①④⑤ D.①③⑤
难度: 中等查看答案及解析
-
类推法在化学学习中经常采用,下列类推的结论正确的是()
A.由Cl2+2KBr=2KCl+Br2,所以F2也能与KBr溶液反应置换出Br2
B.常温下,由Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2
C.由Cu+Cl2
CuCl2,所以Cu+I2
CuI2
D.由钠保存在煤油中,所以钾也可以保存在煤油中
难度: 困难查看答案及解析
-
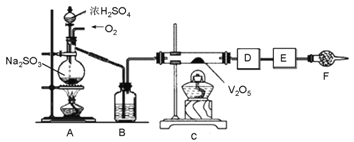
“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:
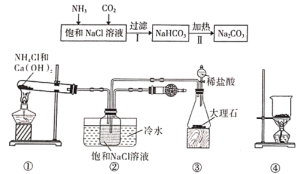
下列叙述错误的是
A.实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B.装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C.向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D.用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
难度: 中等查看答案及解析
-
有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6 B.0∶6∶3∶1 C.6∶0∶3∶11 D.3∶2∶1∶4
难度: 困难查看答案及解析
-
向100mL2mol/L的AlCl3溶液中加入1mol/L的KOH溶液,生成沉淀的质量为7.8g,加入溶液的体积可能为①100mL②300mL③700mL④800mL⑤1000mL()
A.①或② B.②或④ C.②或③ D.②或⑤
难度: 中等查看答案及解析
-
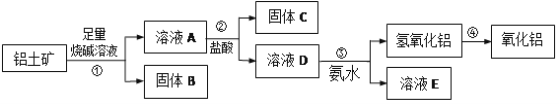
某废催化剂含
、ZnS、CuS及少量的
。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
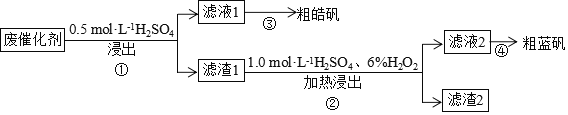
A.滤液1中是否含有
,可以选用KSCN和新制的氯水检验
B.步骤
操作中,先加
,在不断搅拌下,再加入
C.滤渣1成分是
和CuS,滤渣2成分一定是
D.步骤
操作中,生成的气体需用NaOH溶液或
溶液吸收
难度: 中等查看答案及解析