-
为了确定某物质是否变质,所选试剂(括号内物质)错误的是
A. Na2SO3是否被氧化(BaCl2) B. FeCl2是否被氧化(KSCN)
C. KI是否被氧化(淀粉溶液) D. 氯水是否失效(pH试纸)
难度: 中等查看答案及解析
-
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2→CO2+H2O,该反应
A.反应物和生成物中都只含极性分子
B.反应物和生成物均为分子晶体
C.反应时有极性键和非极性键的断裂和它们的生成
D.产物中CO2 的键能大于H2O,所以沸点高于H2O
难度: 简单查看答案及解析
-
用高铁酸钠(Na2FeO4)对湖水消毒,是城市饮水处理的新技术。已知反应Fe2O3+ 3Na2O2= 2Na2FeO4 +Na2O。下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3molNa2O2发生反应,有12mol电子转移
D.在Na2FeO4中Fe为+4价,只有强氧化性,能消毒杀菌
难度: 中等查看答案及解析
-
2014年诺贝尔化学奖授予美国科学家埃里克·贝齐格、威廉·莫纳和德国科学家斯特凡·黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,他们开创性的成就使光学显微镜能够窥探纳米世界。下列说法错误的是
A.黑尔寻找突破“绕射极限”的方法,构建了“受激发射损耗”(STED)显微技术
B.纳米材料是指在三维空间中至少有一维处于纳米尺度范围(1-100×10-6m)的材料
C.得奖者的研究允许人类观察病毒以至细胞内的蛋白质
D.纳米级分辨率的显微镜已在世界范围内广泛运用
难度: 中等查看答案及解析
-
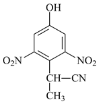
下列有关氮元素化学用语正确的是
A.氮分子的结构式:
B.氮原子最外层的电子云图:
C.NH3 的比例模型:
D.氮原子的轨道表示式:
难度: 中等查看答案及解析
-
铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见图,下列说法完全正确的是
A.铟元素的质量数是114.8
B.铟元素的相对原子质量是115,中子数为66
C.铟元素是一种主族元素,位于第五周期第ⅢA族
D.铟原子最外层有3个能量相同的电子
难度: 中等查看答案及解析
-
时向
的蒸馏水中加入
晶体,保持温度不变,测得溶液的
,下列叙述错误的是
A.此时水的离子积
B.水电离出的
C.水的电离度随温度升高而升高
D.
难度: 困难查看答案及解析
-
砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是
A.分子中共价键键角均为60° B.黄砷中共价键键能大于白磷
C.分子中含有的共价键的数目都是4 D.黄砷的熔点低于白磷
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,常温下,抽去右图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是

A.反应前气体的总体积为0. 448 L
B.生成物中含有0.01NA个分子
C.装置中氢元素的总质量为0.04 g
D.生成物完全溶于水后所得溶液含有0.01 NA个F-
难度: 中等查看答案及解析
-
如图是制取和收集某气体的实验装置,该装置可用于
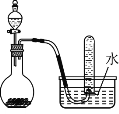
A.用浓盐酸和二氧化锰反应制取Cl2
B.用浓氨水和生石灰反应制取NH3
C.用浓硝酸与铜反应制取NO2
D.用过氧化钠固体和水反应制取O2
难度: 中等查看答案及解析
-
为防止有机物挥发,可加一层水保存,即水封。下列有机物中,既能用水封法保存,又能发生水解和消去反应的是
A.乙醇 B.溴乙烷 C.乙酸乙酯 D.四氯化碳
难度: 中等查看答案及解析
-
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是
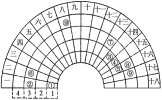
A.⑥、⑧、⑨对应原子的半径依次减小
B.②、⑦的最高价氧化物对应的水化物能相互反应
C.元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族
D.①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物
难度: 中等查看答案及解析
-
如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键)。下列关于该有机物的说法正确的是
A.在一定条件下,可以通过聚合反应生成高分子化合物
B.分子式为C3H6NO2
C.能和NaOH溶液反应,但不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2
难度: 中等查看答案及解析
-
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号
起始时各物质的物质的量 / mol
达到平衡时体系能量的变化/kJ
SO2
O2
SO3
甲
2
1
0
放出热量:Q1
乙
1.8
0.9
0.2
放出热量:Q2
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
难度: 中等查看答案及解析
-
甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述不正确的是
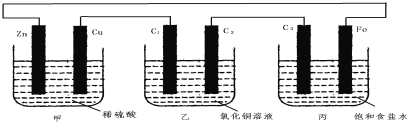
A.甲是化学能转变为电能,乙、丙是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小
难度: 中等查看答案及解析
-
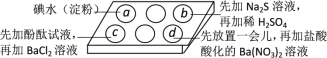
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
A.溶液中无法确定Al3+的存在与否
B.原溶液中不含的离子为:K+、Al3+、CO32-
C.步骤②中可以确定Fe2+、NO3-的存在
D.步骤③中共有2种钡盐沉淀
难度: 困难查看答案及解析
-
测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数x%可采取不同的方法,取a克样品与一定量稀盐酸(过量)充分反应后,下列说法正确的是
A.逸出气体若用碱石灰吸收,增重b克,则x偏小
B.把所得溶液加热蒸干并灼烧至恒重,得c克固体,若灼烧时有固体飞溅出去,x偏大
C.某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂滴定上述反应后的溶液,则x偏小
D.产生的气体冷却至室温后,若测定其体积时未调平量气管和水准管内液面,则x偏小
难度: 中等查看答案及解析
-
已知某高聚物的结构式是
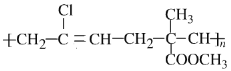 ,其单体的名称为( )
,其单体的名称为( )A.氯乙烯、乙烯和甲基丙烯酸甲酯 B.2-氯-1,3-丁二烯和丁烯酸甲酯
C.3-氯-1,3-丁二烯和丙烯酸甲酯 D.2-甲基丙烯酸甲酯和2-氯-1,3-丁二烯
难度: 中等查看答案及解析
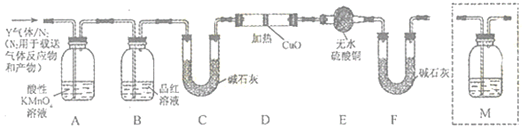
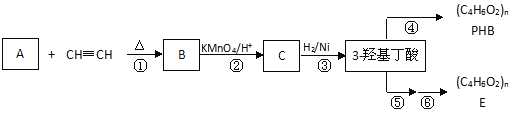

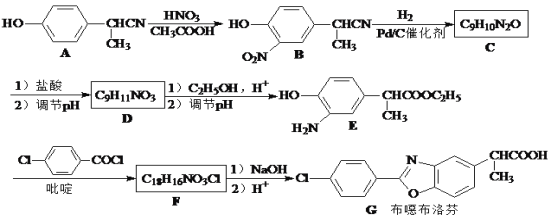
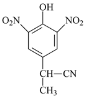 b
b  c
c 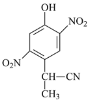 d
d