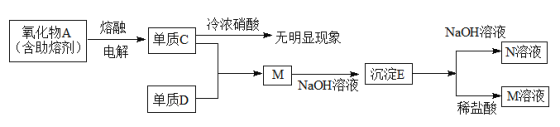
-
元素性质呈现周期性变化的根本原因是( )
A. 核外电子排布呈周期性变化 B. 元素的相对原子质量逐渐增大
C. 核电荷数逐渐增大 D. 元素化合价呈周期性变化
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速度加大的是( )
A.加热
B.不能稀硫酸而用浓硫酸
C.往溶液中加入少量CuSO4固体
D.不能铁片而用铁粉
难度: 简单查看答案及解析
-
下列元素的最高价氧化物对应的水化物酸性最强的是
A.Mg B.S C.Cl D.Si
难度: 简单查看答案及解析
-
将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A.稀硫酸 B.氯水 C.硫酸锌 D.氯化铜
难度: 中等查看答案及解析
-
分子式为C4H8的同分异构体的数目是
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
将NH4HCO3固体在试管中加热,使放出的气体依次通过足量的过氧化钠、盐酸溶液、浓H2SO4后,最后得到的气体是
A.NH3 B.CO2 C.H2O(g) D.O2
难度: 中等查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应式是( )
A.2H++2e-= H2↑ B.Fe - 2e-= Fe2+ C.2H2O + O2+ 4e-= 4OH- D.Fe-3 e-= Fe3+
难度: 简单查看答案及解析
-
除去CO2气体中的少量HCl,最好将气体通过盛有何种溶液的洗气瓶
A.饱和食盐水 B.氢氧化钠溶液
C.饱和NaHCO3溶液 D.饱和Na2CO3溶液
难度: 中等查看答案及解析
-
按C、N、O、F的顺序,其性质表现为递减的是( )
A.最外层电子数 B.原子半径
C.非金属性 D.单质的氧化性
难度: 简单查看答案及解析
-
在强酸溶液中存在大量的Fe2+和Ba2+,那么在该溶液中能大量共存的离子是
A.NO3- B.SO42- C.Cl- D.CO32-
难度: 中等查看答案及解析
-
测定胆矾晶体结晶水含量时,若测定的相对误差大于零,则产生误差的原因可能是
A.加热后容器未放入干燥器中冷却 B.最后两次加热后的质量相差较大
C.加热前称量时容器未完全干燥 D.胆矾晶体中混有加热不分解的杂质
难度: 中等查看答案及解析
-
向NaAlO2浓溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是
A.NO2 B.CO2 C.NH3 D.O2
难度: 中等查看答案及解析
-
X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m
6
C.X、Y可以属于同一周期,也可居于两个不同周期
D.X与Y一定不属于同一主族
难度: 中等查看答案及解析
-
把铁和铜的混合物放入稀硝酸中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的是
A.Fe(NO3)2 B.Cu(NO3)2 C.Fe(NO3)3 D.HNO3
难度: 中等查看答案及解析
-
制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并封存冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中再挤出氨水。其中必须进行的操作及其正确顺序是
A.③②⑤⑥④ B.③②④①⑦ C.③②④⑤⑦ D.②④①⑦⑤
难度: 中等查看答案及解析
-
用标准盐酸滴定氢氧化钠溶液,下列操作步骤正确的是
A.滴入2~3滴紫色石蕊试液作为指示剂
B.锥形瓶用蒸馏水洗净(未经干燥),加入氢氧化钠待测液
C.记录盐酸初、末读数,计算差值得滴入盐酸的体积15.1 mL
D.滴定时,边摇动锥形瓶,边观察滴定管内液面下降情况
难度: 中等查看答案及解析
-
将氢氧化钡溶液滴入含1mol/L的
的明矾溶液中,当生成的沉淀的物质的量最多时,铝元素的主要存在形式为( )
A.
和
B.
C.
D.
和
难度: 困难查看答案及解析
-
等质量的下列烃完全燃烧,耗氧量最少的是
A.C2H6 B.C3H8 C.C4H6 D.C5H10
难度: 中等查看答案及解析
-
用铝热法还原下列物质,制得金属各1 mol,消耗铝最多的是
A.MnO2 B.Fe2O3 C.Cr2O3 D.V2O5
难度: 中等查看答案及解析
-
将1.12 g铁粉加入到25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
A.铁有剩余
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物与还原产物的物质的量之比为2:5
D.溶液中的Fe2+和Fe3+的物质的量之比为6:1
难度: 中等查看答案及解析
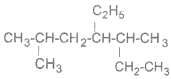 的系统名称是_____________________________。
的系统名称是_____________________________。 的单体的结构简式是____________________。
的单体的结构简式是____________________。