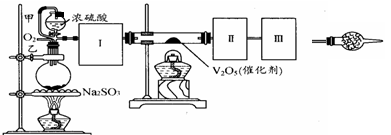
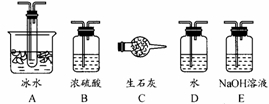
-
城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的( )

A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物等可能是造成X河污染的污染源
C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理
难度: 中等查看答案及解析
-
简单原子的原子结构可用下图形象地表示:
其中表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
A.①②③互为同素异形体 B.①②③互为同位素
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
难度: 中等查看答案及解析
-
氢阴离子(H-)能和NH3反应:H-+ NH3 = NH2-+ H2↑根据上述反应事实可以得出的正确结论是( )
A.NH3有还原性 B. H-是很强的还原剂
C.该反应的还原产物是H2 D. 该反应属于置换反应
难度: 中等查看答案及解析
-
下列有关实验的叙述中,不正确的有( )
①蒸干AlCl3溶液可得纯净的无水氯化铝;
②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;
③无法用分液漏斗将甘油和水的混合液体分离;
④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;
⑥苯与溴水在铁粉的催化作用下制备溴苯;
⑦配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;
⑧在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀。
A.4句 B.5句 C.6句 D.7句
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.过量SO2通入Ba(NO3)2溶液3SO2+2NO3-+3Ba2++2H2O=3BaSO4+2NO+4H+
B.1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
C.甲醛溶液中加入足量的银氨溶液并加热:
HCHO+2[Ag(NH3)2]++2OH-
HCOO-+NH4++2Ag↓+3NH3+H2O
D.向硫酸铝铵矾溶液中滴加过量的氢氧化钡溶液:
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
难度: 中等查看答案及解析
-
将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是( )
A.Cu、Fe3+ B.Fe2+、Fe3+ C.Cu、Cu2+ D.Cu、Fe2+
难度: 中等查看答案及解析
-
分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
⑦依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
⑧根据化学反应的热效应,将化学反应分为放热反应、吸热反应
A.①④⑤⑥ B.③④⑤⑥ C.只有①③ D.全部正确
难度: 中等查看答案及解析
-
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7。
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后
CCl4层呈橙色,用分液漏斗分液。
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。
则关于原溶液的判断中不正确的是( )
A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
B.肯定存在的离子是Na+、K+、SO32-、Br-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响
难度: 中等查看答案及解析
-
下表列举的各组事实中存在因果关系的是( )
选项
陈述Ⅰ(原因)
陈述Ⅱ(结果)
A
O3能吸收紫外线
大气层中的O3被称为地球保护伞
B
钠原子核外电子数比铝少
钠的金属性比铝强
C
氯的非金属性比碘强
酸性:氢碘酸强于盐酸
D
N2+3H2
2NH3是放热反应
工业合成氨的反应在高温下进行
难度: 中等查看答案及解析
-
将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为( )
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.K2SO4·1/2Cr2(SO4)3
难度: 中等查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是( )
①ω=
②C=
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。则下列说法正确的是( )
A.标准状况下,22.4L己烷中共价键数目为19NA
B.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
C.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
难度: 中等查看答案及解析
-
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。

下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素,镓的原子序数为31,属ⅢA元素,镓的熔点为29.78℃,沸点高达2403℃,镓有过冷现象(即冷至熔点以下不凝固),它可过冷到-120℃。下列有关镓的性质及其用途的叙述不正确的是( )
A.镓是制造高温温度计的上佳材料
B.镓能溶于强酸或强碱溶液中
C.镓与锌、锡等金属制成合金,可提高其硬度
D.镓可用于制造半导体材料,这是因为镓的导电性介于导体和绝缘体之间
难度: 中等查看答案及解析
-
下列物质的除杂方法中,合理的是( )
①SO2中混有的SO3杂质可以让混合气体通过浓硫酸除去;②K2CO3中混有的少量NaHCO3,可以用加热的方法除去;③乙烯中混有的SO2气体可以通过溴水除去;④金属铜中含有的少量银和锌可以通过电解精炼的方法除去;⑤KNO3中含有的少量NaCl可以通过重结晶的方法除去。
A.①②④ B. ①④⑤ C. ①②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象: ①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化
C.1mol NH4CuSO3完全反应转移0.5mol电子 D.刺激性气味的气体是氨气
难度: 中等查看答案及解析