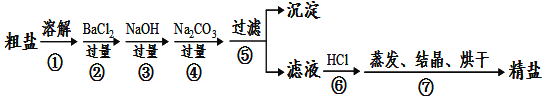
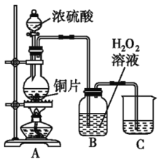
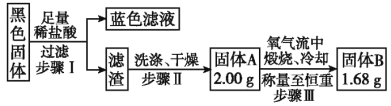
-
FeS2的结构类似于Na2O2,是一种过硫化物。与酸反应时首先生成H2S2,H2S2类似于H2O2,易分【解析】
H2S2===H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为( )A. H2S B. S C. Fe2+ D. Fe3+
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O
D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH-
难度: 中等查看答案及解析
-
如表所示有关物质检验的实验结论正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色
该溶液一定含有SO32-
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊
说明酸性:H2SO3>H2CO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学事实及其解释都正确的是( )
A.NO2与水反应,NO2作还原剂,水作氧化剂
B.某溶液中含有大量的NO3-,该溶液中一定不存在大量的Fe2+
C.闪电时,空气中的N2和O2可直接化合生成NO2
D.除去NO中混有少量NO2气体时,可以用水洗涤后再干燥
难度: 简单查看答案及解析
-
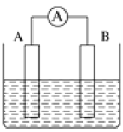
a、b、c、d四种金属片两两相连浸入稀硫酸中都可组成原电池。a、b相连时,a的质量减少;a、c相连时,阳离子移向c;b、d相连时,b上有气泡逸出;c、d相连时,外电路电流从d流向c。据此判断这四种金属活动性由大到小的顺序是( )
A.acbd B.acdb C.cdba D.cabd
难度: 简单查看答案及解析
-
下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A.CuO+2HNO3=Cu(NO3)2+H2O B.FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C.C+4HNO3=CO2↑+2H2O+4NO2↑ D.NH3+HNO3=NH4NO3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.H2和D2互为同位素
B.CH2=CH2和CH2=CH-CH=CH2互为同系物
C.
和
为同分异构体
D.
和
是一种物质
难度: 简单查看答案及解析
-
下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2
CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
难度: 简单查看答案及解析
-
对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
A. 反应过程中的能量关系可用图表示
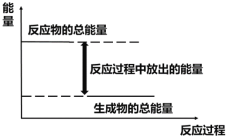
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
难度: 中等查看答案及解析
-
锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )
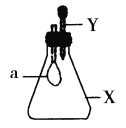
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
难度: 简单查看答案及解析
-
下列“实验结论”与“实验操作及现象”不相符的一组是
选项
实验操作及现象
实验结论
A
向蔗糖中滴加浓硫酸,蔗糖变黑
浓硫酸有吸水性
B
向 KI淀粉溶液中滴加氯水,溶液变成蓝色
氧化性:Cl2>I2
C
向某盐溶液中滴加 KSCN 溶液,溶液变为红色
该溶液中含有 Fe3+
D
向某盐溶液中加入浓 NaOH 溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
该溶液中含有NH 4
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列生产或实验事实引出的结论不正确的是( )
选项
事实
结论
A
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短
当其他条件不变时,升高反应
温度,化学反应速率加快
B
工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环
增大气液接触面积,使SO3的吸收速率增大
C
在容积可变的密闭容器中发生反应:2NH3(g)
N2(g)+3H2(g),把容器的体积缩小一半
反应速率减慢
D
A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快
当其他条件不变时,催化剂可
以改变化学反应速率
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是( )
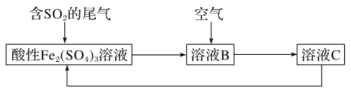
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:O2>SO42-
D.检验溶液B中是否含Fe2+的方法:向溶液B中加入硫氰化钾溶液,无现象,然后加入双氧水溶液,观察是否变红
难度: 简单查看答案及解析
-
碳足量,反应C(s)+H2O(g)
CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加碳的量且表面积保持不变 ②将容器的体积缩小一半 ③保持体积不变,充入He,使体系压强增大 ④保持压强不变,充入He使容器体积变大
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CH2Cl2只有一种结构,说明甲烷是以碳原子为中心的正四面体结构
B.1mol甲烷生成CCl4最多消耗2mol氯气
C.标准状况下,11.2L CHCl3中含有C—Cl键的数目为0.5NA
D.正戊烷分子中所有的碳原子均在同一条直线上
难度: 中等查看答案及解析
-
下列有关氮元素的单质及其化合物的说法错误的有( )
①氮气与氧气在放电的条件下可直接生成NO2 ②铵盐都不稳定,受热分解都生成氨气 ③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 ④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为
A.436kJ B.557kJ C.920kJ D.618kJ
难度: 中等查看答案及解析
-
下列描述的化学反应状态(反应条件略去),不一定是平衡状态的是( )
A.H2(g)+Br2(g)⇌2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g)⇌N2O4(g),恒温、恒压下,反应体系中气体的体积保持不变
C.CaCO3(s)⇌CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D.N2(g)+3H2(g)⇌ 2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
难度: 简单查看答案及解析
-
下列关于链状烷烃的说法正确的有( )
①在链状烷烃分子中,所有的化学键都是单键②分子组成上满足CnH2n+2(n≥1)的有机物定是链状烷烃③丙烷分子中所有的碳原子一定在同一平面上 ④烷烃不能使酸性髙锰酸钾溶液褪色,说明烷烃不能发生氧化反应⑤CH3CH(CH3)CH2CH3的一氯代物有四种⑥碳原子间以单键结合,碳原子剩余价键全部与氢原子结合的有机物一定是链状烷烃
A.3个 B.4个 C.5个 D.6个
难度: 中等查看答案及解析
-
将100mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是( )
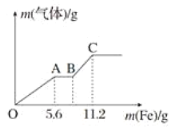
A.原混合酸溶液中H2SO4的浓度为2.0mol•L-1 B.A点对应消耗NO3-物质的量为0.1mol
C.B点对应消耗铁粉的质量为8.4g D.OA段产生的气体是NO,BC段产生的气体是H2
难度: 中等查看答案及解析
-
将40mL NO2和NO的混合气体通入倒立于水槽中盛满水的试管里,充分反应后试管中剩余20mL气体,则原混合气体中NO2和NO的体积比为( )
A.2:1 B.3:1 C.1:1 D.1:2
难度: 中等查看答案及解析