-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A.原子半径:r(X) < r(Y) < r(Z) < r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强
D.X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
下面的排序不正确的是 ( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
反应NH4Cl+NaNO2
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:
B. N2的结构式:N=N
C. Na+的结构示意图:
D. H2O的电子式:
难度: 简单查看答案及解析
-
用化学用语表示 NH3+ HCl
NH4Cl中的相关微粒,其中正确的是( )
A. 中子数为8的氮原子:
B. HCl 的电子式:
C. NH3的结构式:
D. Cl−的结构示意图:
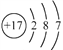
难度: 简单查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.质量数为31的磷原子:
B.氟原子的结构示意图:
C.CaCl2的电子式:
D.明矾的化学式:Al2(SO4)3
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.中子数为10的氧原子:
B.Mg2+的结构示意图:
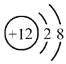
C.硫化钠的电子式:
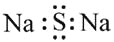
D.甲酸甲酯的结构简式:C2H4O2
难度: 中等查看答案及解析
-
下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:
B.氯离子(Cl-)的结构示意图:

C.氯分子的电子式:
D.氯乙烯分子的结构简式:H3C-CH2Cl
难度: 中等查看答案及解析
-
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
A.1s22s22p63s23p2→1s22s22p63s23p1
B.1s22s22p63s23p3→1s22s22p63s23p2
C.1s22s22p63s23p4→1s22s22p63s23p3
D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1
难度: 中等查看答案及解析
-
如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
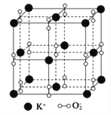
A. K2O B. K2O2 C. K2O3 D. KO2
难度: 中等查看答案及解析
-
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.HF、HCl、HBr、HI的热稳定性依次减弱
D.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
难度: 中等查看答案及解析
-
主族元素A和B可形成组成为AB2的离子化合物,则A、B两原子的最外层电子排布分别为( )
A.ns2np2和ns2np4 B.ns2和ns2np4 C.ns2和ns2np5 D.ns1和ns2
难度: 中等查看答案及解析


