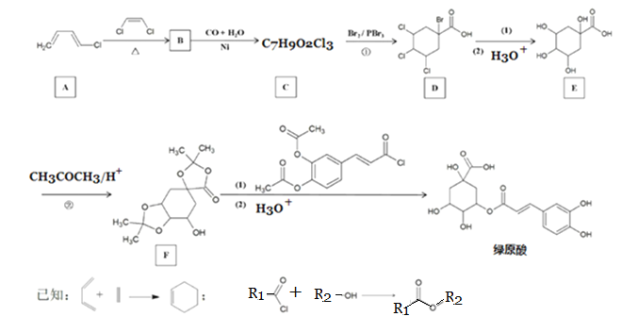
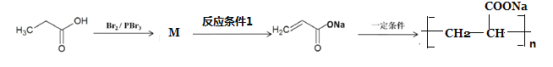
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A.食用油反复加热会产生稠环芳香烃等有害物质
B.用填埋法处理未经分类的生活垃圾
C.疫情期间可经常用稀释后的“84”消毒液对人手频繁接触的金属门把手进行杀菌消毒
D.中国“人造太阳”利用氘和氚发生化学反应产生上亿度高温
难度: 中等查看答案及解析
-
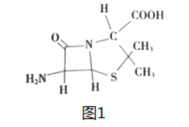
下列有机物具有较高的对称性。下列有关它们的说法正确的是

A.有机物a 所有原子都在同一平面内
B.有机物b 的一氯代物为6种
C.有机物c 和有机物d互为同系物
D.52g 有机物a和c的混合物充分燃烧消耗标准状况下的氧气112L
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y 原子最外层电子数等于内层电子数的2 倍,Q 的单质与稀硫酸反应生成X的单质。向100mLX2R 的水溶液中缓缓通入RZ2气体,溶液 pH 与 RZ2体积关系如下图。下列说法不正确的是
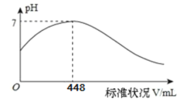
A.X2R溶液的浓度为0.4mol/L
B.X简单阴离子半径大于锂离子半径
C.工业上采用电解熔融Q的氧化物的方法冶炼Q 的单质
D.RZ3 通入BaCl2、Ba(NO3)2溶液中,均产生相同的白色沉淀物质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法错误的是
A.1 mol Cl2溶于水,溶液中Cl-、HClO、ClO-粒子数之和小于2NA
B.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键
C.3.0gC18O与15N2的混合物中所含中子数为1.6NA
D.0.1mol Na2O2与足量潮湿的二氧化碳反应转移电子数为0.1NA
难度: 简单查看答案及解析
-
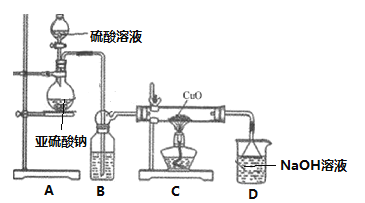
下列选用的仪器和药品能达到实验目的的是
A.
 加热熔融的氢氧化钠固体
加热熔融的氢氧化钠固体B.
 验证
验证C.
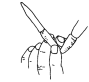 检查碱式滴定管是否漏液
检查碱式滴定管是否漏液D.
 侯氏制碱法制碳酸氢钠
侯氏制碱法制碳酸氢钠难度: 简单查看答案及解析
-
下列图示与对应的叙述正确的是
A.
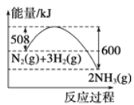 反应达到平衡后,升高温度,平衡常数K值变大
反应达到平衡后,升高温度,平衡常数K值变大B.
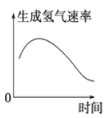 表示镁条放入盐酸中生成氢气速率随时间的变化
表示镁条放入盐酸中生成氢气速率随时间的变化C.
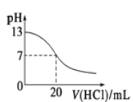 表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化D.
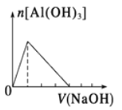 表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化难度: 简单查看答案及解析
-
25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg
或lg
,下列叙述正确的是
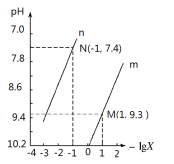
A.25 ℃时,CO32-+H2O
HCO3-+OH-的平衡常数为1.0×10-7.6
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.曲线m表示pH与 -lg
的变化关系
D.Ka1(H2CO3)的数量级为10-7
难度: 困难查看答案及解析