-
短周期主族元素X、Y、Z、W、Q的原子序数依次增加。已知,离子化合物甲是由X、Y、Z、W四种元素组成的,其中,阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒;Q元素原子半径是短周期主族元素中最大的;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,其中丁在常温下为气体。下列说法正确的是
A. 甲中既含离子键,又含共价键
B. 丙和戊的混合物一定显酸性
C. 丁一定能使湿润的红色石蕊试纸变蓝
D. 原子半径:X<Y<Z<W
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA。下列说法正确的是
A. 1 L 1 mol·L-1的NaHSO3溶液中含有的离子数为3NA
B. 5.6g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
C. 常温常压下,22.4L的37Cl2中所含的中子数为40NA
D. 硝酸与铜反应生成0.1mol NOx时,转移电子数为0.2NA
难度: 中等查看答案及解析
-
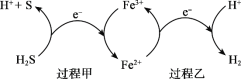
天然气因含有少量 H2S 等气体开采应用受限。T.F 菌在酸性溶液中可实现天然气的催化脱硫,其原理如下图所示。下列说法不正确的是( )

A.脱硫过程 O2 间接氧化 H2S
B.该脱硫过程需要不断添加 Fe2(SO4)3 溶液
C.亚铁是血红蛋白重要组成成分,FeSO4 可用于治疗缺铁性贫血
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
难度: 中等查看答案及解析
-
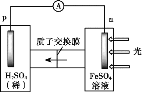
流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
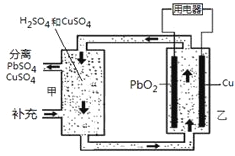
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
难度: 中等查看答案及解析
-
对甲基苯乙烯(
)是有机合成的重要原料。下列对其结构与性质的推断错误的是( )
A. 分子式为
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种
不考虑立体异构
D. 分子中所有原子可能处于同一平面
难度: 中等查看答案及解析
-
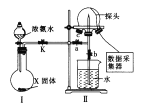
探究Na2O2与水的反应,实验如图:(已知:H2O2
H+ + HO2-、HO2-
H+ + O22-)下列分析不正确的是
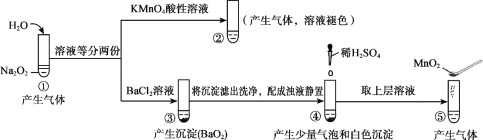
A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D.通过③能比较酸性:HCl>H2O2
难度: 中等查看答案及解析
-
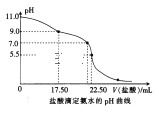
根据下列图示所得出的结论正确的是( )
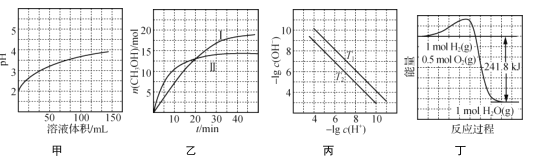
A.图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D.图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
难度: 中等查看答案及解析

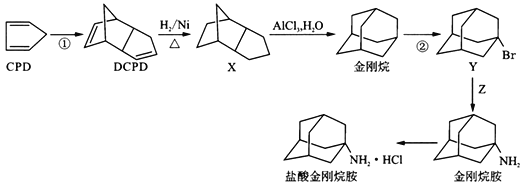
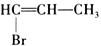 为原料合成
为原料合成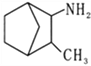 ,设计其合成路线_________。
,设计其合成路线_________。