-
已知:①在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝;②在上述蓝色溶液中,滴加过量的Na2SO3溶液,蓝色逐渐消失;③取实验②生成的溶液滴加BaCl2溶液,有白色沉淀生成。下列判断正确的是( )
A. 上述实验证明氧化性:ClO->I2>SO42-
B. 上述实验③中的白色沉淀是BaSO4,一定不含有BaSO3
C. 实验①中硫酸的作用是作氧化剂和酸化剂
D. 实验②证明SO32-既有氧化性又有还原性
难度: 中等查看答案及解析
-
人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A. 负极,被氧化 B. 正极,被还原 C. 负极,被还原 D. 正极,被氧化
难度: 简单查看答案及解析
-
短周期元素X的最高价氧化物的化学式为XO3,X处于元素周期表中 ( )
A.第2周期第ⅡA族 B.第2周期第ⅢA族
C.第3周期ⅣA族 D.第3周期ⅥA族
难度: 简单查看答案及解析
-
下列排列顺序正确的是
A.粒子半径:Al3+>Mg2+>Na+ B.热稳定性:HI>HBr>HCl>HF
C.酸性:H2CO3<H2SO4<HClO4 D.碱性:Al(OH) 3>Mg(OH)2>NaOH
难度: 简单查看答案及解析
-
下列有关化学与科研、生产、生活相关的说法不正确的是( )
A.84消毒液能消杀新冠病毒,它也具有漂白性
B.常用铝槽车装运浓硫酸及浓硝酸是因为它们和铝不发生化学反应
C.锂离子电池是新一代可充电的绿色电池
D.电力是污染最小的一种二次能源
难度: 简单查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其可逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ·mol-1、Cl—Cl键的键能为243 kJ·mol-1、H—Cl键的键能为x,若1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)放出183 kJ的热量,则x为( )
A.496 kJ·mol-1 B.431 kJ·mol-1 C.862 kJ·mol-1 D.248 kJ·mol-1
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
四种短周期元素在周期表中的位置如图,
其中只有M为金属元素,下列说法不正确的是( )
A.原子半径Z<M
B.Z位于元素周期表中第二周期、第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的小
D.X的最高价氧化物不溶于任何酸
难度: 简单查看答案及解析
-
能鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液(可以加热)的一种试剂是( )
A.Ba(OH)2溶液 B.Ba(NO3)2溶液 C.BaCl2溶液 D.AgNO3溶液
难度: 简单查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A.
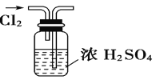 干燥Cl2
干燥Cl2B.
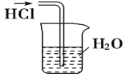 吸收HCl
吸收HClC.
 石油的蒸馏
石油的蒸馏D.
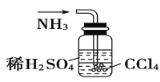 吸收NH3
吸收NH3难度: 简单查看答案及解析
-
下列各组离子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+ B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3- D.NH4+、SO42-、K+、OH-
难度: 简单查看答案及解析
-
下列各项中表达正确的是( )
A.硫离子:S﹣1
B.用电子式表示氯化氢分子的形成过程:

C.氢氧根的电子式:
D.HClO的结构式:H-O-Cl
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.所有物质中一定存在化学键
B.含共价键的化合物不一定是共价化合物
C.金属元素和非金属元素形成的化合物一定是离子化合物
D.溶于水能导电的化合物就是离子化合物
难度: 简单查看答案及解析
-
下列叙述错误的是( )
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K ③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素⑤多电子原子中,在离核较近的区域内运动的电子能量较高 ⑥盐酸可与碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,则Cl 比S的非金属性强 ⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构。
A.①③⑤⑥ B.②④⑥ C.②③④⑦ D.①⑤⑥
难度: 简单查看答案及解析
-
相同质量的四份铜片,分别置于足量的下列酸中,在一定条件下反应,所得到的气体的物质的量最多的是( )
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
难度: 简单查看答案及解析
-
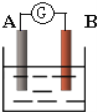
对于锌-铜-稀硫酸组成的原电池装置中,当导线中有0.1mol电子通过时,理论上的两极变化是( )
①锌片溶解了3.25g ②锌片增重3.25g
③铜片上析出0.1g H2 ④铜片上析出0.1mol H2
A.①和③ B.①和④ C.②和③ D.②和④
难度: 中等查看答案及解析
-
Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合后再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.①③ C.②③ D.②④
难度: 中等查看答案及解析
-
对3NO2+H2O=2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.在反应中若有6 mol NO2参与反应时,有3 mol电子发生转移
D.氧化剂与还原剂的质量比为1∶2
难度: 中等查看答案及解析
-
根据下列反应事实:①由X、Y电极组成的原电池,Y电极增重;②由X、Z电极组成的原电池,Z电极质量减少;③由Y、W电极组成的原电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>Y>X>W D.Z>X>Y>W
难度: 中等查看答案及解析
-
无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2 B.NO、CO2
C.NO2、CO2 D.NO、CO2、N2
难度: 中等查看答案及解析