-
运用化学知识对下列说法进行分析,不合理的是
A.从健康的角度考虑臭氧比氯气更适合作自来水的消毒剂
B.在“新冠肺炎战疫”发挥了重要作用的熔喷布口罩,其主要生产原料聚丙烯是混合物
C.“一带一路”是现代丝调之路。丝绸的主要成分是蛋白质,属于天然高分子化合物
D.水墨山水画不易褪色的原因是墨汁中的炭黑具有吸附性
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是( )
A.20gH218O和D2O的混合物中含有中子10NA
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.1L0.1mol·L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA
D.pH=1的硫酸溶液,含有氢离子数目为2NA
难度: 中等查看答案及解析
-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20。Q的简单氢化物和其最高价含氧酸可以化合成盐,X与Q同周期且是该周期主族元素中原子半径最小的元素;Z-具有与氩原子相同的电子层结构;Q、Y、W原子的最外层电子数之和为9。下列说法一定正确的是( )
A.X与Z的简单氢化物的水溶液均呈强酸性
B.Z和W形成的化合物的水溶液呈中性
C.Y与Z形成的化合物只含离子键
D.简单氢化物的沸点:Q>X
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是( )
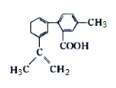
A.苯环上的一氯代物有3种
B.含有2种官能团
C.分子中的所有碳原子一定共面
D.能发生氧化反应、取代反应、还原反应
难度: 中等查看答案及解析
-
海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
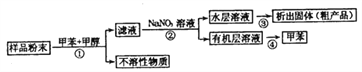
下列关于该流程中各步骤的说法中,错误的是( )
选项
步骤
采用装置
主要仪器
A
①
过滤装置
漏斗
B
②
分液装置
分液漏斗
C
③
蒸发装置
坩埚
D
④
蒸馏装置
蒸馏烧瓶
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
我国某科研团队设计了一种新型能量存储/转化装置(如图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是( )
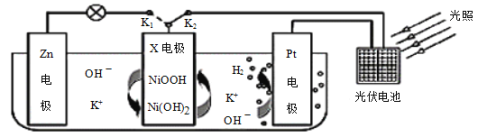
A.制氢时,溶液中K+向Pt电极移动
B.供电时,Zn电极附近溶液的pH不变
C.供电时,X电极发生还原反应
D.制氢时,X电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O
难度: 中等查看答案及解析
-
常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。

下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数
难度: 困难查看答案及解析
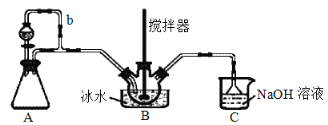
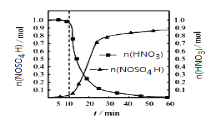
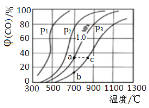
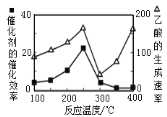
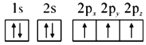 b.
b.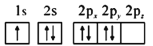
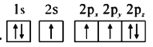 d.
d.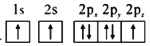
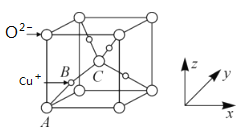
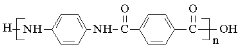 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: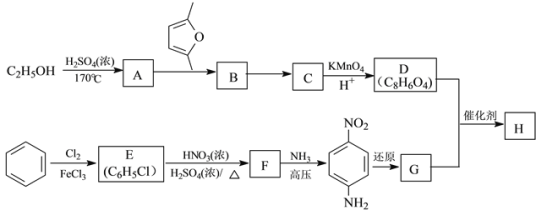
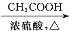 CH3COOC2H5)。
CH3COOC2H5)。