-
下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A. 氯化钠与蔗糖熔化 B. 碘和干冰升华
C. 镁和硫熔化 D. 金刚石与氧化钠熔化
难度: 中等查看答案及解析
-
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
A. 三氯化硼液态时能导电而固态时不导电 B. 三氯化硼加到水中使溶液的pH升高
C. 三氯化硼分子呈平面三角形,属非极性分子 D. 分子中所有原子都满足最外层8电子稳定结构
难度: 中等查看答案及解析
-
①PH3的分子构型为三角锥形,②BeCl2的分子构型为直线形,③CH4分子的构型为正四面体形,④CO2为直线形分子,⑤BF3分子构型为平面正三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是
A.①⑥为极性分子,②③④⑤为非极性分子
B.只有④为非极性分子,其余为极性分子
C.只有②⑤是极性分子,其余为非极性分子
D.只有①③是非极性分子,其余是极性分子
难度: 中等查看答案及解析
-
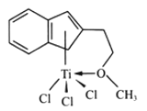
某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.配合物中中心原子的电荷数为6
B.该配合物可能是平面正方形结构
C.Cl﹣和NH3分子均与中心铂离子形成配位键
D.该配合物的配体只有NH3
难度: 中等查看答案及解析
-
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子一般能量最高 B.电离能最小的电子能量最高
C.在离核最近区域内运动的电子能量最低 D.p轨道电子能量一定高于s轨道电子能量
难度: 简单查看答案及解析
-
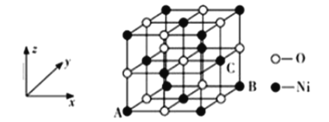
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
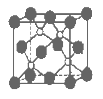
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
难度: 中等查看答案及解析
-
下列现象与氢键有关的有几项( )
①H2O的熔、沸点比VIA族其他非金属元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子高温下也很稳定
A.5项 B.4项 C.3项 D.2项
难度: 中等查看答案及解析
-
有关晶体的叙述中正确的是( )
A.在SiO2晶体中,最小的单元环是由6个硅原子组成的六元环
B.在124g白磷(P4)晶体中,含P—P共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C—C键键能小于Si—Si键
D.12g金刚石中含C原子与C—C键之比为1:2
难度: 困难查看答案及解析
-
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2−+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如图所示,下列说法不正确的是( )
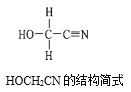
A.HOCH2CN分子中没有手性碳原子
B.1mol HOCH2CN分子中含有σ键的物质的量为5mol
C.[Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D.HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
难度: 中等查看答案及解析
-
下列化合物中含有2个手性碳原子的是( )
A.
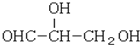 B.
B.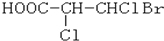
C.
D.
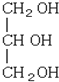
难度: 简单查看答案及解析
-
下列分子价层电子对互斥模型与分子空间构型不一致的是( )
A.SO3 B.BF3 C.NH3 D.CH4
难度: 中等查看答案及解析
-
As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
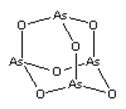
A.As2O3 分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
难度: 中等查看答案及解析
-
下列分子的沸点比较正确的共有()
①H2O>H2S;②H2O>HF;③H2S>H2Se;④CO>N2;⑤CH4>C2H6;
⑥正戊烷>新戊烷;⑦邻羟基苯甲醛>对羟基苯甲醛
A. 3项 B. 4项 C. 5项 D. 6项
难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定
B.氯化钠熔化时离子键未被削弱
C.冰熔化时水分子中共价键发生断裂
D.原子晶体中共价键越强,熔点越高
难度: 中等查看答案及解析
-
预测H2S和BF3的立体结构,两个结论都正确的是( )
A.V形;平面三角形 B.V形;三角锥形
C.直线形;平面三角形 D.直线形;三角锥形
难度: 简单查看答案及解析
-
有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.X和Q结合生成的化合物为离子化合物
B.T和Z各有一种单质的空间构型为正四面体形
C.元素Y和Q可形成化合物Y2O3
D.ZO2是极性键构成的非极性分子
难度: 困难查看答案及解析
-
下列元素性质的递变规律正确的是
A.第一电离能:B<Be<Mg<Na
B.元素的电负性:O>N>S>P
C.气态氢化物的稳定性:NH3<CH4<PH3<SiH4
D.原子半径:Be<B<C<N
难度: 中等查看答案及解析
-
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
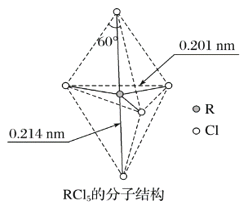
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能各不相同
难度: 困难查看答案及解析
-
一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是

A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
难度: 困难查看答案及解析
-
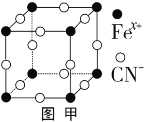
Fe为过渡金属元素,在工业生产中具有重要的用途。已知NO能被FeSO4溶液吸收生成配合物 [Fe(NO)(H2O)n]SO4,该配合物的中心离子的最外层电子数与配体提供的电子总数之和为26。下列有关说法正确的是( )
A.该配合物的化学式为[Fe(NO)(H2O)5]SO4
B.该配合物中所含非金属元素均位于元素周期表p区
C.1 mol该配合物与足量Ba(OH)2溶液反应可生成2 mol沉淀
D.该配合物中阳离子呈正八面体结构,阴离子呈正四面体结构
难度: 中等查看答案及解析