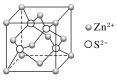
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、SO42-
B.c(Al3+)=0.5mol·L-1的溶液中:Na+、K+、AlO2-、SO42-
C.能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl-
D.能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3-
难度: 简单查看答案及解析
-
短周期主族元素X 、Y 、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价.下列说法正确的是( )
A.简单离子半径大小顺序:rW>rZ>rY
B.元素W的氧化物对应水化物的酸性比Y 的强
C.X与Y形成的原子晶体X3Y4的熔点可能比金刚石高
D.X与W形成的化合物和Z与W形成的化合物的化学键类型相同
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A.H、D、T具有相同的质子数,是氢元素的三种核素
B.OH-与H3O+组成元素相同,所含质子数相同
C.13C与15N有相同的中子数
D.15N的核外电子数与核内中子数相等
难度: 简单查看答案及解析
-
对以下科学家的发明发现,分析不合理的是( )
A.屠呦呦研究小组发现抗疟新药青蒿素,帮助很多人摆脱了疟疾的威胁
B.侯德榜制碱法,最终制得纯碱的化学式为:NaHCO3
C.阿伏加德罗提出分子学说,使人们对物质结构的认识发展到一个新的阶段
D.门捷列夫发现元素周期律,使化学的研究变得有规律可循
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是( )
A.质量数为37的氯原子:
Cl
B.二氧化碳分子的比例模型:
C.NH4Br的电子式:
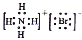
D.对羟基苯甲醛的结构简式:
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是( )
A.图1表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化
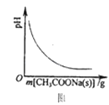
B.图2表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
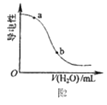
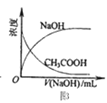
C.图3表示将NaOH稀溶液滴加到CH3COOH稀溶液中,NaOH、CH3COOH浓度随NaOH溶液体积的变化曲线
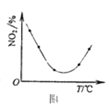
D.图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1mol·L-1氨水加水稀释后,溶液中
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
室温下,有两种溶液:①0.01mol•L-1NH3•H2O溶液、②0.01mol•L-1NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.通入少量HCl气体
B.加入少量NaOH固体
C.加入少量H2O
D.适当升高温度
难度: 中等查看答案及解析
-
下列实验现象(或操作)与盐类水解无关的是( )
A.配制FeCl3溶液时,将FeCl3固体溶解在浓盐酸中,然后再用水稀释到所需的浓度
B.1mol/L的醋酸加水稀释,溶液的pH增大,导电能力减弱
C.氮肥NH4HCO3与钾肥K2CO3混施可能会降低肥效
D.向20mL沸水中滴加适量饱和FeCl3溶液,形成红褐色胶体
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是( )
A.N、P、As的电负性随原子序数的增大而增大
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为纺锤形,能量也相等
D.C、N、O的气态氢化物稳定性依次减弱
难度: 中等查看答案及解析
-
最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种新粒子是由3个氢原子核(只有质子)和2个电子构成,对于这种粒子,下列说法中正确的是( )
A.是氢的一种新的同分异构体 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
难度: 简单查看答案及解析
-
草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )
A.V(NaOH) = 0时,c(H+) >1×10-7mol/L
B.V(NaOH)<10 mL时,可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时,溶液的pH为9,则10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)>10 mL时,可能存在c(OH- )>c(Na+)>c(C2O42-)
难度: 中等查看答案及解析