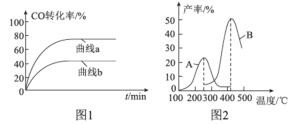
-
2019年7月1日起,上海进入垃圾分类强制时代,随后西安等地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法正确的是
A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取
C.废旧电池中含有镍、镉等重金属,不可用填埋法处理
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
难度: 中等查看答案及解析
-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20。Q的简单氢化物和其最高价含氧酸可以化合成盐,X与Q同周期且是该周期主族元素中原子半径最小的元素;Z一具有与氩原子相同的电子层结构;Q、Y、W原子的最外层电子数之和为9。下列说法一定正确的是
A.X与Z的简单氢化物的水溶液均呈强酸性
B.Y与Z形成的化合物只含离子键
C.简单氢化物的沸点:Q<X
D.Z和W形成的化合物的水溶液呈碱性
难度: 困难查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
难度: 困难查看答案及解析
-
科学家通过实验发现环己烷在一定条件下最终可以生成苯,从而增加苯及芳香族化合物的产量
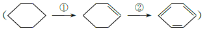 ,下列有关说法正确的是
,下列有关说法正确的是A.①②两步反应都属于加成反应
B.环己烯的链状同分异构体超过10种(不考虑立体异构)
C.环己烷、环己烯、苯均易溶于水和乙醇
D.环己烷、环己烯、苯均不能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列实验装置能达到实验目的的是( )
选项
A.
B.
C.
D.
实验装置

实验目的
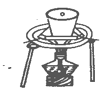
用坩埚灼烧分离氯化钾和氯化铵的混合物
实验室制备干燥纯净的氯气
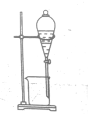
用乙醇提取溴水中的溴
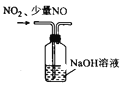
尾气处理混有少量NO的NO2
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
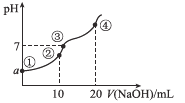
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
难度: 困难查看答案及解析
-
2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )
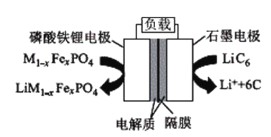
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.放电时,负极反应式为LiC6-e-=Li++6C
C.电池总反应为M1-xFexPO4+LiC6
LiM1-xFexPO4+6C
D.充电时,Li+移向磷酸铁锂电极
难度: 中等查看答案及解析