-
将含有KCl、CuBr2、Na2SO4三种物质的水溶液用铂电极进行电解,且电解时间足够长。有以下结论:
①溶液中几乎没有Br-;②电解质溶液为无色;③最终溶液显碱性;④K+、Na+和SO42-的浓度几乎没有变化。正确的是(设Cl2、Br2全部从溶液中逸出)( )
A. ①②③ B. 仅③ C. ①④ D. 均正确
难度: 中等查看答案及解析
-
下列叙述中错误的是
A. 点燃甲烷不一定会爆炸
B. 甲烷燃烧放出大量的热,所以是一种很好的气体燃料
C. 煤矿的矿井要注意通风并严禁烟火,以防爆炸的发生
D. 点燃甲烷前不必进行验纯
难度: 简单查看答案及解析
-
下列操作能达到实验目的的是( )
实验目的
实验操作
A
证明Cl的非金属性比C强
将盐酸滴入放有大理石的烧杯中,观察是否有气泡产生。
B
比较Mg与Al的金属性强弱
将镁条与铝片用导线相连,放入盛有NaOH溶液的烧杯中,观察现象。
C
证明增大反应物浓度,能加快化学反应速率
将两块表面积相同的锌粒分别放入稀硫酸和浓硫酸中。
D
证明KCl中存在离子键
熔融状态的KCl是否导电
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于能量转换的认识中不正确的是( )
A. 电解水生成氢气和氧气时,电能转化为化学能
B. 绿色植物进行光合作用时,太阳能转化为化学能
C. 煤燃烧时,化学能主要转化为热能
D. 信号弹爆炸时,镁燃烧产生的能量全部转化为光能
难度: 简单查看答案及解析
-
下列变化中,不需要破坏化学键的是
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
难度: 简单查看答案及解析
-
下列各组物质中互为同分异构体的是( )
A.12C和14C B.金刚石和石墨
C.CO(NH2)2和NH4CNO D.H2、D2、T2
难度: 简单查看答案及解析
-
科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是
A.它的最外层电子数为4 B.它的金属性比铅强
C.它具有+2、+4价 D.它的最高价氧化物的水化物是强酸
难度: 简单查看答案及解析
-
一定温度下,在恒容密闭容器中进行可逆反应2NO2(g) ⇌2NO(g) + O2(g),下列可以作为反应达到化学平衡状态标志的有:①单位时间内生成n mol O2的同时生成n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③NO2、NO、O2的物质的量之比为2:2:1的状态;④密闭容器中压强不再改变的状态;⑤混合气体的颜色不再改变的状态;⑥密闭容器中气体的密度不再改变的状态
A. ①④⑤ B. ③④⑤ C. ④⑤ D. ④⑤⑥
难度: 中等查看答案及解析
-
决定化学反应速率的根本因素是( )
A.温度和压强
B.反应物的浓度
C.参加反应的各物质的性质
D.催化剂的加入
难度: 简单查看答案及解析
-
下列物质属于分子晶体的化合物是
A.石英 B.硫磺 C.干冰 D.食盐
难度: 中等查看答案及解析
-
在2A(g)+B(g)
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·L-1· s-1 B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1 D. v(D)=10 mol·L-1·min-1
难度: 中等查看答案及解析
-
下列说法中正确的是
A.Ba(OH)2·8H2O与NH4Cl晶体的反应是吸热反应
B.化学反应中能量变化的大小与反应物的质量多少无关
C.含有共价键的化合物一定是共价化合物
D.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.O2、O3互为同位素 B.1H、2H、3H是三种核素
C.
和
互为同素异形体 D.H2O与D2O的组成元素不同
难度: 中等查看答案及解析
-
下列化学用语中,表示正确的是( )
A.氯离子的结构示意图:
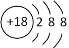 B.CH4的球棍模型:
B.CH4的球棍模型:
C.MgF2的电子式:
D.次氯酸的结构式:H–Cl–O
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是
①MgF2 ②Na2O2 ③KOH ④CO2 ⑤NaClO ⑥H2SO4 ⑦NH3·H2O
A.②③⑤ B.②③④⑤ C.①②③⑤ D.①③⑤⑥
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.单质、共价化合物、离子化合物中都存在共价键
B.二次电池的充放电为可逆反应
C.需要加热才能发生的反应一定是吸热反应
D.同一化学反应,相同条件下用不同物质表示的速率可能不同,但意义相同。
难度: 中等查看答案及解析
-
甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生置换反应;③甲的氧化物对应的水化物酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是
A.①② B.①②③ C.①②③④ D.①②③④⑤
难度: 简单查看答案及解析
-
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2。下列关于该电池的说法错误的是
A.镁片作为负极
B.食盐水作为电解质溶液
C.电池工作时镁片逐渐被消耗
D.电池工作时实现了电能向化学能的转化
难度: 中等查看答案及解析
-
普通锌锰干电池的构造如图所示,其电池反应的方程式为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)下列说法不正确的是( )

A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.正极的电极反应为:NH4++MnO2+e-=MnO(OH)+NH3
难度: 简单查看答案及解析
-
下列叙述错误的是
A. 通常情况下,甲烷跟强酸、强碱和强氧化剂都不反应
B. 甲烷化学性质稳定,不能被任何氧化剂氧化
C. 甲烷与Cl2反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
D. 甲烷的四种有机取代产物有一种气态,其余三种为液态且都不溶于水
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.由铜、锌作电极与硫酸溶液组成的原电池中,溶液中的H+向正极移动
B.钢铁发生腐蚀时,正极上发生的反应为Fe-2e-=Fe2+
C.铜锌原电池工作时,若有13 g锌被溶解,溶液中就有0.4 mol电子通过
D.原电池必须有两个活泼性不同的金属作电极
难度: 简单查看答案及解析
-
A、B两种元素为同一周期ⅡA和ⅢA元素,若A元素的原子序数为x,则B元素的原子序数可能为( )
①x+1 ②x+21 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.①③ B.②④ C.①③⑤ D.②④⑥
难度: 简单查看答案及解析
-
用锌片与1mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A. 对该反应体系加热 B. 用浓硫酸代替稀盐酸
C. 不用锌片,改用锌粉 D. 加入少量 1mol·L-1硫酸
难度: 简单查看答案及解析
-
100 mL 6 mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.醋酸钾溶液 B.硫酸铜溶液 C.氯化钠固体 D.烧碱溶液
难度: 中等查看答案及解析
-
能证明乙烯里含有一个碳碳双键的事实是( )
A.乙烯能使酸性KMnO4溶液褪色
B.乙烯分子里碳、氢原子个数比为1∶2
C.乙烯完全燃烧生成的CO2和H2O的物质的量相等
D.乙烯容易与溴水发生反应,且1 mol乙烯完全加成消耗1 mol溴单质
难度: 简单查看答案及解析
-
下列结论正确的是
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
A.①④⑤ B.③⑥ C.②④⑤⑥ D.①③④
难度: 中等查看答案及解析
-
将1 mol甲烷和适量的Cl2混合后光照,充分反应后生成CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为
A. 1 mol B. 3 mol
C. 4.5 mol D. 6 mol
难度: 中等查看答案及解析
-
下列对元素周期表说法不正确的是
A. 共有7个周期和16个族
B. 在过渡元素中可以寻找各种优良的催化剂
C. 如果已知元素的最外层电子数为2,由此不能确定该元素在周期表中的位置
D. 目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g)
C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均相对分子质量
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)==2C(g)+D(g),经2min后B的浓度减少0.6mol·L-1。下列说法正确的是
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 在2min内的反应速率,用B表示是0.3mol·L-1min-1
C. 分别用B、C、D表示反应的速率,其比值是3:2:1
D. 在这2min内B和C两物质浓度是逐渐减小的
难度: 中等查看答案及解析
-
五种主族元素X、Y、Z、M和N在周期表中的位置如图所示。下列说法正确的是

A. M的原子半径比N小
B. Y和Z既可形成Z2Y,也可形成Z2Y2
C. X2M的热稳定性比X2Y强
D. M和N的氧化物的水化物均为强酸
难度: 简单查看答案及解析
-
已知:2N2O5(g)
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
1000
1500
n(N2O5)/mol
10.0
7.0
5.0
5.0
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率
难度: 中等查看答案及解析
-
下列各组溶液,同时开始反应,出现浑浊最早的是( )
A. 20℃时 50mL0.05mol·L-1 Na2S2O3 溶液与 50mL0.1mol·L-1 硫酸混合
B. 20℃时 5mL0.1mol·L-1 Na2S2O3 溶液与 5mL0.1mol·L-1硫酸混合
C. 10℃时 50mL0.05mol·L-1Na2S2O3 溶液与 50mL0.1mol·L-1硫酸混合
D. 10℃时 5mL0.1mol·L-1 Na2S2O3 溶液与 5mL0.1mol·L-1硫酸混合
难度: 中等查看答案及解析
-
用惰性电极电解AgNO3溶液,说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
难度: 中等查看答案及解析
-
在下图装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是 ( )

A.直流电源中,A是正极
B.两池内CuSO4溶液浓度均不改变
C.两铁极上最初析出物相同
D.P池内溶液的质量逐渐减小
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有的电子数为10NA
B.NO2和N2O4混合气体共46 g,所含原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g 14C所含原子数为NA
难度: 中等查看答案及解析
-
已知: (1)Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s),ΔH=+234.1kJ•mol-1
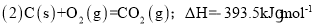 则
则的ΔH是( )
A.-824.4 kJ•mol-1 B.-627.6kJ•mol-1 C.-744.7kJ•mol-1 D.-169.4kJ•mol-1
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Y、Z三种元素可组成酸,且受热易分解
D.由X、Z、W三种元素可组成碱,且受热易分解
难度: 困难查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A.稀硫酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=+57.3 kJ·mol-1
B.在101 kPa下H2(g)的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
C.已知CH3OH的燃烧热为726.8 kJ·mol-1,则有CH3OH(l)+
O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
D.已知9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1
难度: 中等查看答案及解析
-
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=AkJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-220kJ/mol
若H-H、O=O和O-H键的键能分别为436/496和462kJ/mol,则a为
A.+130 B.+350 C.-332 D.-118
难度: 简单查看答案及解析