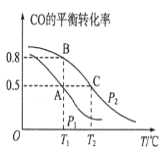
-
不能证明乙酸是弱酸的实验事实是( )
A.pH = 1的CH3COOH溶液加水稀释到10倍,测得pH < 2
B.常温下0.10mol∙L-1 CH3COOH溶液的pH = 3
C.CH3COOH溶液中加入少量醋酸钠固体,溶液pH增大
D.0.10mol∙L-1 CH3COOH溶液可使紫色石蕊变红
难度: 简单查看答案及解析
-
盐类水解在工农业生产和日常生活中有着广泛的应用,有关应用或说法与盐类水解无关的是
A.用热的纯碱溶液洗涤餐具上的油污
B.生活中常用明矾净水
C.用稀硫酸或浓氨水除去铜器表面的铜绿
D.长期使用硫酸铵化肥的土壤,易变酸性,可施用适量的熟石灰
难度: 简单查看答案及解析
-
对滴有酚酞试液的Na2CO3溶液,下列操作后红色会加深的是
A.降温 B.通入CO2气体
C.加入少量CaCl2固体 D.加入少量NaOH固体
难度: 简单查看答案及解析
-
下列化学反应属于吸热反应的是( )
A.碘的升华 B.氢氧化钙与氯化铵晶体混合
C.镁与稀盐酸反应 D.生石灰溶于水
难度: 中等查看答案及解析
-
在一定条件下,反应N2+3H2⇌2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03mol/(L·min)
B.v(N2)=0.02mol/(L·min)
C.v(NH3)=0.17mol/(L·min )
D.v(NH3)=0.01mol/(L·min)
难度: 中等查看答案及解析
-
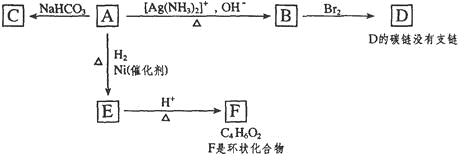
在密闭容器,一定条件下进行反应:mA(g)+nB(g)⇌pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是( )
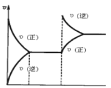
A.m+n<p+q B.逆反应是放热反应
C.m+n>p+q D.正反应是吸热反应
难度: 简单查看答案及解析
-
在一恒温恒压的密闭容器中,N2与H2的反应已达平衡,若再向体系中充入氩气平衡将( )
A.向左移动 B.向右移动 C.不移动 D.移动方向不定
难度: 简单查看答案及解析
-
浅绿色的Fe(NO3)2溶液中,存在水解平衡:Fe2++2H2O⇌Fe(OH)2+2H+。若在此溶液中加入盐酸,则溶液颜色( )
A.浅绿色略变深 B.颜色基本不变 C.变黄 D.变为红褐色。
难度: 中等查看答案及解析
-
下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是
A.FeCl3 B.Ca(HCO3)2 C.NaAlO2 D.Na2SO3
难度: 中等查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ 、Na+ 、、NO3- 、Cl- B.K+、 Na+、 Cl- 、 NO3-
C.K+ 、Na+ 、Cl- 、AlO2- D.K+ 、NH4+ 、SO42-- 、NO3-
难度: 中等查看答案及解析
-
醋酸的电离方程式为CH3COOH(aq)⇌H+(aq)+CH3COO-(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液Ka=1.75×10-5(Ka表示酸的电离常数)。下列说法正确的是( )
A.升高温度,c(H+)增大,Ka变大
B.该溶液中加少量CH3COONa固体,平衡正向移动
C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
难度: 中等查看答案及解析
-
常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1 B.0.017mol·L-1
C.0.05mol·L-1 D.0.50mol·L-1
难度: 简单查看答案及解析
-
为了使配制的NH4Cl溶液中NH4+的浓度与Cl-的浓度比为1∶1,可加入适量的最佳试剂是( )
A.HCl B.NaCl C.氨水 D.NaOH
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.50℃时,水在0.1mol/L盐酸中与在0.1mol/LNaOH溶液中的电离程度相同
B.pH等于7的溶液一定呈中性
C.水的离子积表示在水溶液中由水电离出的H+和OH-浓度符合Kw=c(H+)·c(OH-)
D.将0.06mol·L-1氢氧化钡溶液与0.1mol·L-1盐酸溶液等体积混合,该混合溶液的pH等于13(忽略混合过程中溶液体积变化)
难度: 中等查看答案及解析
-
室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
A.若pH>7,则一定是C1V1=C2V2
B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-)+C(OH-)
C.当pH=7时,若V1=V2,一定是C2>C1
D.若V1=V2,C1=C2,则C(CH3COO-)+C(CH3COOH)=C(Na+)
难度: 简单查看答案及解析
-
央视焦点访谈节目曾报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如下图所示,下列说法正确的是( )
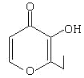
A.该有机物的分子式为C7H6O3
B.1mol该有机物最多能与2molH2发生加成反应
C.该有机物的一种芳香族同分异构体能发生银镜反应
D.该有机物能发生取代、加成、氧化和还原反应
难度: 中等查看答案及解析