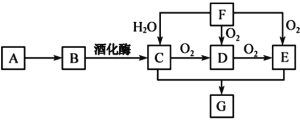
-
下列各式中属于正确的水解反应离子方程式的是( )
A.CH3COOH + OH-⇌CH3COO-+H2O
B.S2-+2H2O⇌H2S+2OH-
C.HCO3- + H2O⇌CO32- + H3O+
D.NH4++H2O⇌NH3∙H2O+H+
难度: 简单查看答案及解析
-
下列物质的水溶液因水解而呈酸性的是( )
A.HCl B.FeCl3 C.NaHCO3 D.CH3COONa
难度: 中等查看答案及解析
-
下列属于放热反应的是( )
A.二氧化碳和碳反应生成一氧化碳
B.镁在二氧化碳中燃烧
C.氯化铵和氢氧化钡晶体反应
D.将浓硫酸与水1:1混合
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.25℃,1 LpH=13的NaOH溶液中含有OH-的数目为0.1NA
B.标准状况下,4.6 g NO2和N2O4混合物中含氧原子数为0.3NA
C.标准状况下,6.72 L Cl2与水充分反应,转移电子数为0.3NA
D.0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3-
B.0.10 mol·L-1 KI溶液:Al3+、Fe3+、Cl-、SO42-
C.滴入酚酞变红色的溶液:Na+、K+、CO32-、Cl-
D.c(H+)=1×10-12 mol·L-1的溶液:Mg2+、Cu2+、NO3-、SO42-
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.CCl4的电子式:
B.乙烷分子的分子式:CH3CH3
C.苯分子的最简式为:C6H6
D.丙烷的球棍模型:
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关。下列说法正确的是( )
A.燃料电池的能量转化率可达100%
B.“熔喷布”可制作N95型等口罩,生产“熔喷布”的主要原料是聚丙烯,它属于纯净物
C.体积分数75%的乙醇溶液可用于医疗消毒
D.牛油、纤维素和蛋白质都是天然高分子化合物
难度: 中等查看答案及解析
-
下列关于有机物的说法,正确的是( )
A.石油裂化的目的是为了得到乙烯、丙烯等短链气态不饱和烃
B.丙烷的一氯代物和七氯代物均只有两种
C.乙酸乙酯在碱性条件下的水解反应可被称为皂化反应
D.CH3CH218OH和CH3COOH反应生成的水的相对分子质量为20
难度: 中等查看答案及解析
-
括号内物质为杂质,下列除去杂质的方法不正确的是( )
A.乙醇(水):先加生石灰后蒸馏
B.溴苯(溴):用NaOH溶液洗涤后分液
C.乙烷(乙烯):用溴水洗气
D.乙酸乙酯(乙酸):用NaOH溶液洗涤后分液
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.蒸馏时可通过加碎瓷片防暴沸
B.精密pH试纸无法区分pH=5.1和pH=5.6的两种NH4Cl溶液
C.可以用水鉴别出失去标签的苯和四氯化碳
D.根据燃烧产生的气味,可区分棉纤维和蛋白质纤维
难度: 中等查看答案及解析
-
常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A.C3H8O2 B.CH4 C.C2H5OH D.C2H4
难度: 简单查看答案及解析
-
下列由实验得出的结论正确的是( )
实验
结论
A.
某有机物完全燃烧,只生成CO2和H2O
该有机物属于烃类物质
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中羟基上的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性强于碳酸的酸性
D.
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生产的氯甲烷具有酸性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.18O2和16O3互为同位素
B.正己烷和2,2−二甲基丙烷互为同系物
C.C60和C70是具有相同质子数的不同核素
D.H2NCH2COOCH3和CH3CH2NO2是同分异构体
难度: 中等查看答案及解析
-
已知拆开1 mol O2(g)中的化学键需要吸收498 kJ的能量。根据能量变化示意图,下列说法不正确的是
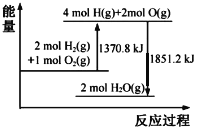
A.2H2(g)+O2(g)=2H2O(l) △H=-480.4 kJ·molˉ1
B.H2O(g)=H2(g)+
O2(g) △H=240.2 kJ·molˉ1
C.拆开1 mol H2(g)中的化学键需要吸收436.4 kJ的能量
D.H2(g)和O2(g)形成H2O(g)中的1 mol H-O键放出462.8 kJ的能量
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.已知C(石墨,s)
C(金刚石,s) △H>0,则金刚石比石墨稳定
B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
D.N2(g)+3H2(g)
2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.室温下浓度均为0.1 mol/L的盐酸和氨水混合呈中性时,消耗盐酸的体积大于氨水
B.室温下向0.1 mol/L氨水中加入等浓度等体积的盐酸,溶液导电能力增强
C.室温下pH相等的CH3COOH溶液和盐酸中,c(OH-)相等
D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)=c(Na+)
难度: 中等查看答案及解析
-
一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)
3C(g)。反应过程中的部分数据如下表所示:
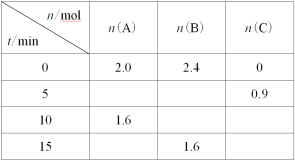
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L−1·min−1
B.该反应在10min后才达到平衡
C.平衡状态时,c(C)=0.6mol·L−1
D.物质B的平衡转化率为20%
难度: 中等查看答案及解析
-
在一个绝热容积不变的密闭容器中发生N2(g)+3H2(g)
2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
A.容器内气体的总质量保持不变
B.断裂lmolN≡N键的同时断裂3molH-H键
C.容器中H2的浓度保持不变
D.v(N2):v(H2):v(NH3)=1:3:2
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:2NO(g)+2CO(g)
N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.升高温度同时充入氮气
C.加催化剂同时增大压强
D.降低温度同时增大压强
难度: 中等查看答案及解析
-
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO32-,则下列推断正确的是 ( )
A.负极反应为H2+2OH--2e-===2H2O
B.该电池可在常温或高温时进行工作,对环境具有较强的适应性
C.该电池供应2 mol水蒸气,同时转移2 mol电子
D.放电时负极有CO2生成
难度: 中等查看答案及解析
-
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.
 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加B.
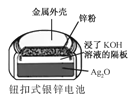 正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−
正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−C.
 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄D.
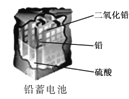 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降难度: 困难查看答案及解析
-
不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是
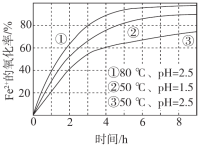
A.由①、②可知, pH越大,+2价铁越易被氧化
B.由②、③推测,若pH>7,+2价铁更难被氧化
C.由①、③推测,FeCl2被O2氧化的反应为放热反应
D.60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
难度: 中等查看答案及解析
-
下列通过实验得出的结论中正确的是:
A.某溶液试样中加入MgCl2溶液,无明显现象,再加入过量NaOH溶液,生成白色沉淀,则该溶液试样中存在HCO3-
B.取某固体试样加水后的上层清液进行焰色反应,透过蓝色钴玻璃看到紫色火焰,则该固体试样中存在K+
C.某溶液试样中加入稀HNO3酸化Ba(NO3)2溶液,生成白色沉淀,则该试样中存在SO42-
D.某固体试样完全溶于稀硫酸,滴加KSCN溶液,出现血红色,则该固体试样中存在Fe3+
难度: 中等查看答案及解析
-
常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
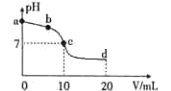
A.a点溶液的pH=12
B.b点时c(CH3COO-)>c(NH4+)
C.c点时水的电离程度最大
D.d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
难度: 困难查看答案及解析