-
下列关于文献记载的说法正确的是
A. 《天工开物》中“世间丝麻裘褐皆具素质”,文中“丝、麻”的主要成分都是蛋白质
B. 《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”,该提取过程属于化学变化
C. 《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂”,描述的是升华和凝华过程
D. 《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,涉及的实验操作是蒸馏
难度: 困难查看答案及解析
-
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的
中,含有
个中子
B. pH=1的H3PO4溶液中,含有
个
C. 2.24L(标准状况)苯在O2中完全燃烧,得到
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加
个P-Cl键
难度: 困难查看答案及解析
-
化合物
(a)、
(b)、
(c)同属于薄荷系有机物,下列说法正确的是
A.a、b、c 都属于芳香族化合物 B.a、b、c都能使溴水褪色
C.由a生成c的反应是氧化反应 D.b、c互为同分异构体
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A
向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐期消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
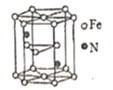
2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
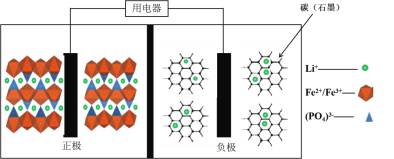
原理如下:(1−x)LiFePO4+xFePO4+LixCn
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向左移动
难度: 困难查看答案及解析
-
已知草酸为二元弱酸:H2C2O4
HC2O4﹣+ H+ Ka1 ; HC2O4﹣
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
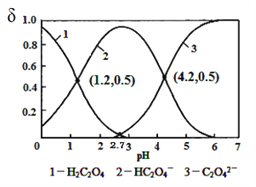
A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
难度: 困难查看答案及解析
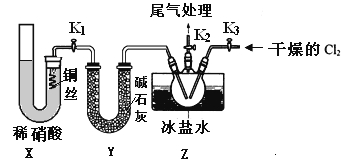
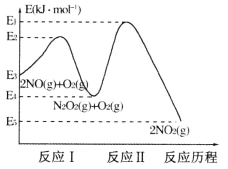
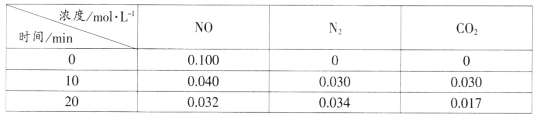
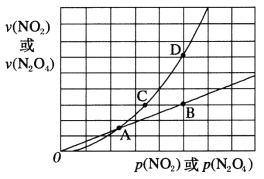
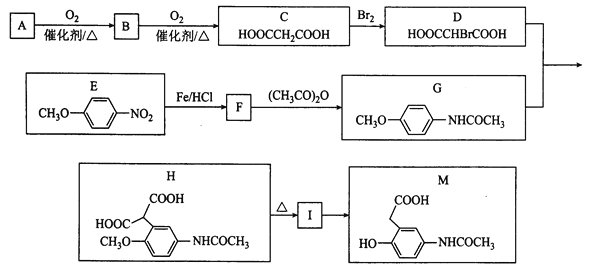
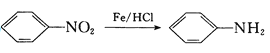 (-NH2容易被氧化);
(-NH2容易被氧化);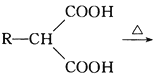 R-CH2COOH
R-CH2COOH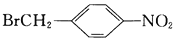 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备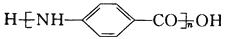 的合成路线:______。
的合成路线:______。