-
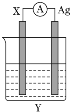
X、Y、Z、W是四种原子序数依次增大的主族元素。已知X、Y、Z是短周期中的三种非金属元素,X元素原子的核外电子数等于所在周期数;Y单质为无色气体,性质稳定,常用作保护气;Z元素原子的最外层电子数是内层电子数的3倍;W是地壳中含量最高的金属元素。下列说法中正确的是
A. 四种元素的原子半径从大到小的顺序是W>Z>Y>X
B. 元素X、Y和Z可以组成共价化合物,也可以组成离子化合物
C. 化合物YX3水溶液能导电,所以YX3属于电解质
D. 工业上采用电解WCl3溶液的方法制取W单质
难度: 中等查看答案及解析
-
A、B、C、D、E为原子序数相邻且依次递增的同一短周期元素,下列说法正确的是(m、n均为正整数)
A.若HnEOm为强酸,则D是位于VA族以后的非金属元素
B.若C的最低化合价为-3,则E的气态氢化物的分子式为H2E
C.A、B的最高价氧化物水化物均为碱,则碱性A(OH)n强于 B(OH)n+1
D.若B为金属,则C一定为金属元素
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm−(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述的判断正确的是
①a-b=n-m ②元素的原子序数a>b>c>d ③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y ⑤离子半径r(Rm−)>r(Zn−)>r(Yn+)>r(Xm+)
A.②③⑤正确 B.只有③正确 C.①②③④正确 D.①②③正确
难度: 中等查看答案及解析
-
少量铁片与l00mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O②加KNO3溶液③滴入几滴浓盐酸④加入少量铁粉⑤加NaCl溶液⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
①甲基的电子式
②Cl-的结构示意图:
③乙烯的分子式:CH2=CH2
④中子数为20的氯原子:
⑤乙酸分子的比例模型:
⑥氯乙烷的结构式
A.④ B.③④⑤ C.④⑤⑥ D.①③④⑤⑥
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 在化学反应中发生物质变化的同时,不一定发生能量变化
B. ΔH>0表示放热反应,ΔH<0表示吸热反应
C. ΔH的大小与热化学方程式中化学计量数无关
D. 生成物释放的总能量大于反应物吸收的总能量时,ΔH<0
难度: 简单查看答案及解析
-
下列关于有机物的叙述正确的是
A.除去乙烷中少量的乙烯,可用酸性高锰酸钾溶液洗气
B.苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应
C.煤中含有苯、甲苯,可先干馏后分馏的方法把它们分离出来
D.棉织品与丝织品可以用灼烧法进行鉴别
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色
I−的还原性强于Cl−
B
向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去
该气体一定是乙烯
C
测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大
C的非金属性比Si强
D
向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成
1-溴丙烷没有水解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 凡是含有苯环的化合物均可以称为芳香烃类化合物
B. 有机物CH2=CH—O—CHO中含有两种官能团
C. 若两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体
D. 凡是分子组成相差一个或几个CH2原子团的两种物质,一定互为同系物
难度: 中等查看答案及解析
-
下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板
b极板
a电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
正极
CuCl2
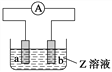
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于碱金属某些性质的排列中正确的是 ( )
A.密度:Li<Na<K<Rb<Cs B.原子半径: Li<Na<K<Rb<Cs
C.熔点、沸点:Li<Na<K<Rb<Cs D.还原性:Li>Na>K>Rb>Cs
难度: 简单查看答案及解析
-
下列关于热化学方程式和反应的热效应的叙述中,正确的是( )
A.已知2C(s)+2O2(g)===2CO2(g)ΔH1 2C(s)+O2(g)===2CO(g)ΔH2 则ΔH1>ΔH2
B.一定条件下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3放热19.3 kJ,热化学方程式为N2(g)+3H2(g) ⇄ 2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知OH-(aq)+H+ (aq)===H2O(l) ΔH=-57.3 kJ/mol则稀硫酸溶液与稀氢氧化钡溶液反应的反应热ΔH=2×(-57.3) kJ/mol
D.相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量
难度: 中等查看答案及解析
-
以下能说明氯的非金属性比硫强的事实是
①HClO的氧化性比H2SO4的氧化性强;
②常温下氯气是气态而硫是固态;
③氯气能溶于水而硫难溶于水;
④HCl比H2S稳定;
⑤H2S能被Cl2氧化成硫单质;
⑥HClO4酸性比H2SO4强;
⑦氯气与氢气化合比硫与氢气化合要容易进行;
⑧氯的最高价为+7价而硫的最高价为+6价。
A.①②③④⑤⑥⑦⑧ B.①④⑤⑥⑦
C.④⑤⑥⑦⑧ D.④⑤⑥⑦
难度: 中等查看答案及解析
-
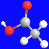
短周期主族元素R、X、Y、Z的原子序数依次增大,Y、Z原子最外层电子数之和等于X原子最外层电子数的2倍,R和Y位于同主族。R、X和Z构成一种分子的结构式如图所示,下列说法错误的是( )
A.原子半径:Y>Z>X>R
B.YR和YZ都是离子化合物
C.Z的氧化物对应的水化物是强酸
D.常温常压下,X的氢化物可能呈液态
难度: 中等查看答案及解析
-
下列说法不正确的有几个()
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③18gH2O中含有的中子数为10NA
④标准状况下,等体积CH4和HF所含的分子数相同
⑤通过化学变化可以实现
与
之间的相互转化
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析