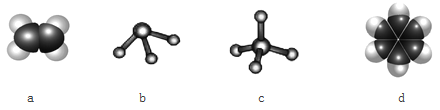
-
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
A. 原子序数:X<Y
B. 原子半径:X>Y
C. 原子的最外层电子数:X>Y
D. 得电子能力:X>Y
难度: 简单查看答案及解析
-
下列说法错误的是
A. 与Na反应的剧烈程度:CH3COOH>H2O>CH3CH2OH
B. 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应
C. 淀粉和纤维素都可以作为工业上生产葡萄糖的原料
D. 油脂都不能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
《天工开物》中如下描述“共煅五个时辰,其中砂末尽化成汞,布于满釜。”下列金属的冶炼方法与此相同的是
A. 钠 B. 铝 C. 银 D. 铁
难度: 简单查看答案及解析
-
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl + NaOH = NaCl + NH3↑ + H2O B. Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑
C. Cl2 + 2NaOH = NaClO + NaCl + H2O D. 2Na2O2 + 2H2O = NaOH + O2↑
难度: 简单查看答案及解析
-
一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
正极
负极
电解质溶液
A
Zn
Cu
CuCl2
B
Zn
Cu
ZnCl2
C
Cu
Zn
H2SO4
D
Cu
Zn
CuSO4
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关反应限度的说法错误的是( )
A. 某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关
B. 可逆反应的限度不随反应条件的改变而改变
C. 化学反应的限度决定了反应物在该条件下的最大转化率.
D. 炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度
难度: 中等查看答案及解析
-
化学知识无处不在,下列与古诗文记载对应的化学知识不正确的是( )
古诗文记载
化学知识
A
绿蚁新醅酒,红泥小火炉
在酿酒的过程中,葡萄糖发生了水解反应
B
南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之.
泥土具有吸附作用,能将红糖变白糖
C
陶成雅器,有素肌、玉骨之象焉
制陶的主要原料是黏土,烧制陶瓷属硅酸盐工业
D
采蒿墓之属,晒干烧灰,以原水淋汁,久则凝淀如“石”,浣衣发面.
“石”即石碱,具有碱性,遇酸产生气体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年7月1日起,上海进入垃圾分类强制时代,随后西安等地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法正确的是
A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取
C.废旧电池中含有镍、镉等重金属,不可用填埋法处理
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
难度: 中等查看答案及解析
-
某校学生用化学知识解决生活中的问题,下列家庭小实验中不合理的是 ( )
A.用高度白酒进行皮肤消毒
B.用米汤(含淀粉)检验加碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3溶液)洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
难度: 中等查看答案及解析
-
下列关于有机化合物的结构、性质的叙述正确的是( )
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“—OH”
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. C5H10O2的同分异构体中,能与NaHCO3反应生成CO2的有4种
B. 糖类、油脂、蛋白质都是电解质
C. 乙烯使溴水、酸性高锰酸钾溶液褪色的反应类型相同
D. 将碘酒滴到未成熟的苹果肉上变蓝说明苹果肉中的淀粉已水解
难度: 中等查看答案及解析
-
化学与生活、生产密切相关,下列说法正确的是
A.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
B.“玉不琢不成器”、“百炼方能成钢”发生的均为化学变化
C.小苏打是制作面包等糕点的膨松剂,也是治疗胃酸过多的常用药剂
D.纤维素供给人体能量时,先在体内水解成葡萄糖再被氧化
难度: 简单查看答案及解析
-
下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤双原子分子组成的物质中一定存在非极性共价键
⑥熔融状态能导电的化合物是离子化合物
A.②③④ B.②④⑥ C.①③⑥ D.①③⑤
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法正确的是
A.丝绸的主要成分是蛋白质 B.电器起火应选用泡沫灭火剂灭火
C.光导纤维的成分是晶体硅 D.生活用水的净化与消毒可用明矾
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,原子序数之和为42,X原子的核外电子总数等于Y的最外层电子数,Z原子最外层只有1个电子,W能形成酸性最强的含氧酸。下列说法正确的是
A.单质的熔点:Z>X B.Z与Y、W均能形成离子化合物
C.气态氢化物的沸点:X<Y<W D.X、Z的氧化物均含非极性键
难度: 中等查看答案及解析
-
下列各组化合物中,化学键的类型完全相同的是( )
①CaCl2 和Na2S ②CO2 和CS2 ③Na2O 和Na2O2 ④HCl 和NaOH
A.①② B.①③ C.②③ D.②④
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是
①Ca(OH)2
②H2S
③ OH﹣
④Al3+ Al3+ ⑤N2
⑥CO2
A. ①②③④ B. ⑤⑥ C. ②③⑤⑥⑦ D. ①④
难度: 困难查看答案及解析
-
下列事实或做法与化学反应速率无关的是
A. 将食物存放在温度低的地方 B. 用铁作催化剂合成氨
C. 将煤块粉碎后燃烧 D. 用浓硝酸和铜反应制备NO2气体
难度: 简单查看答案及解析
-
某种碱性氢氧燃料电池的的正极反应式为:O2+4e-+2H2O = 4OH-。下列有关该电池的叙述正确的是
A.工作时,电解质溶液中的OH-向正极移动
B.工作一段时间后,电解液中KOH的物质的量浓度减小
C.负极上发生的反应为H2-2e-= 2H+
D.若电池在工作过程中有0.4mol电子转移,则正极消耗2.24L O2
难度: 简单查看答案及解析
-
氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
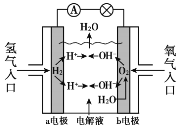
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
难度: 中等查看答案及解析
-
航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
A. 上述反应瞬间产生大量高温气体推动航天飞机飞行
B. 反应属于分解反应
C. 反应从能量变化上说,主要是化学能转变为热能和动能
D. 在反应中高氯酸铵只起氧化剂作用
难度: 中等查看答案及解析
-
在一定温度时,将1mol A和2mol B放入容积为5 L的某密闭容器中发生如下反应:A(s)+2B(g)
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( )
A.在5min内该反应用C的浓度变化表示的反应速率为0.02mol·(L·min)-1
B.在5min时,容器内D的浓度为0.2mol·L-1
C.该可逆反应随反应的进行,容器内压强逐渐增大
D.5min时容器内气体总的物质的量为3mol
难度: 简单查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A. Na与水反应时增大水的用量
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. 在K2SO4与BaCl2两溶液反应时,增大反应容器体积
D. Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
难度: 简单查看答案及解析
-
在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强 B.混合气体的平均相对分子质量
C.A的物质的量 D.B的物质的量浓度
难度: 简单查看答案及解析
-
某化工厂发生苯爆燃特大事故。下列说法错误的是
A. 苯是一种环状有机物 B. 苯分子中含有碳碳双键
C. 苯的分子式为C6H6 D. 苯在氧气中燃烧产生浓烟
难度: 简单查看答案及解析
-
下列实验操作与温度计的使用方法均正确的是(加热装置略)( )
A
B
C
D
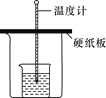
苯与浓硝酸、浓硫酸制硝基苯
乙醇与浓硫酸作用制乙烯
中和热的测定
蒸馏分离水与乙醇的混合物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
丙烯酸(CH2 = CH—COOH )是一种重要的化工原料,可通过下列反应制备。
2CH3CH = CH2 + 3O2催化剂,加热2CH2 = CH—COOH + 2H2O
下列关于丙烯酸的说法不正确的是
A. 与乙酸互为同系物 B. 能与NaHCO3溶液反应
C. 能与乙醇发生酯化反应 D. 能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列说法正确的是:
A. 分子式为C7H8,分子中含有苯环的烃的一氯代物有4种
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
C. 如图所示实验可证明元素的非金属性:Cl>C>Si
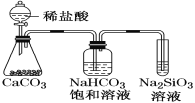
D. C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点正丁烷低于异丁烷
难度: 中等查看答案及解析
-
下列资源的利用涉及化学变化的是
A. 沙里淘金 B. 海水晒盐 C. 石油分馏 D. 煤的干馏
难度: 简单查看答案及解析
-
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:
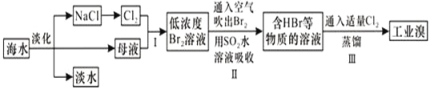
A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
难度: 中等查看答案及解析