-
合成氨反应为 N2(g)+3H2(g)
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
A.一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态
B.取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3
C.一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小
D.一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
一定条件下将0.1mol N2和0.3mol H2置于恒容密闭容器中发生反应:N2+3H2
2NH3.下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3
B.增大压强能使反应速率减小
C.降低反应体系的温度能加快反应速率
D.向容器中再加入N2,能加快反应速率
难度: 简单查看答案及解析
-
在体积为2L的密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2+O2
2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
A.小于1.2 mol B.1.2 mol C.大于1.6 mol D.1.6 mol
难度: 简单查看答案及解析
-
深海中存在可燃冰(CH4•nH2O固体).已知:CH4•nH2O(s)
CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
A.低温高压 B.高温低压 C.低温低压 D.高温高压
难度: 简单查看答案及解析
-
在一个密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
A.c(SO3)=0.4mol/L
B.c(SO2)=c(SO3)=0.15mol/L
C.c(O2)=0.35mol/L
D.c(SO2)+c(SO3)=0.4mol/L
难度: 中等查看答案及解析
-
将0.1mol•L﹣1的KI溶液和0.05mol•L﹣1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I﹣
2Fe2++I2”的是( )
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成(用于证明Fe2+存在)
④
滴入淀粉溶液
溶液变蓝色
A.①和② B.②和④ C.②和③ D.①和③
难度: 中等查看答案及解析
-
在25℃、1.01×105 Pa下,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol﹣1能自发进行的合理解释是( )
A.该反应是分解反应 B.该反应的熵增效应大于焓变效应
C.该反应是熵减反应 D.该反应是放热反应
难度: 中等查看答案及解析
-
为探讨反应X+Y
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反
应速率的判断正确的是( )
c(X)
c(Y)
所需时间(秒)
0.10
0.10
0.60s
0.20
0.10
0.15s
0.20
0.05
0.30s
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比
难度: 困难查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L﹣1•mim﹣1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
难度: 困难查看答案及解析
-
恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
A.若体积减小一半,压强增大,V正增大,V逆减小
B.平衡向右移动,混合气体颜色一定会变浅
C.若体积减小一半,压强增大,但小于原来的两倍
D.平衡向右移动,混合气体的平均相对分子量减小
难度: 中等查看答案及解析
-
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)
Na2S(s)+4H2O(g).下列说法正确的是( )
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为50%
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一密闭容器中进行,下列说法或结论能够成立的是( )
A.当 v(CO)(正)=v(H2)(正)时,反应达平衡状态
B.其他条件不变,适当增加C(s)质量会使平衡正向移动
C.保持体积不变,充入少量He使体系压强增大,反应速率一定增大
D.其他条件不变仅将容器的体积缩小一半,再次平衡时H2O(g)的平衡浓度可能是原来的2.1倍
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.相同条件下,溶液中Fe3+、Zn2+ 、Cu2+的氧化性依次减弱
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.根据反应2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
难度: 简单查看答案及解析
-
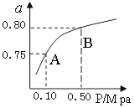
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变
化关系如图.下列说法正确的是( )

①若当温度升高后,则图中θ>45°
②若再加入B,则正、逆反应速率均逐渐增大
③若再加入B,则再次达到平衡时反应体系气体密度不变
④平衡时B的转化率为50%
A.①③ B.②③ C.①④ D.③④
难度: 困难查看答案及解析
-
如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,F受压力恒定.甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )

A.达到平衡时,隔板K最终停留在0刻度左侧的2到4之间
B.若达到平衡时,隔板K最终停留在左侧1处,则乙中C的转化率小于50%
C.若达到平衡时,隔板K最终停留在左侧靠近2处,则乙中F最终停留在右侧的刻度大于4
D.如图II所示若x轴表示时间,则y轴可表示甲乙两容器中气体的总物质的量或A的物质的量
难度: 极难查看答案及解析
-
常温时,下列叙述正确的是
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中
C.pH均为11的NaOH和NH3·H2O溶液中,水的电离程度不相同
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1.0×10—3mol·L—
1盐酸的pH=3.0,1.0×10—8mol·L—1盐酸的pH=8.0
D.将pH=2的某酸溶液和pH=12的KOH溶液等体积混合,所得溶液的pH≤7
难度: 中等查看答案及解析
-
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是
A.柠檬酸的电离会抑制碳酸的电离
B.该碳酸饮料中水
的电离受到抑制
C.常温下,该碳酸饮料中KW的值大于纯水中KW的值
D.打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度
难度: 中等查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4则△H4正确表达式为
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2+3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
难度: 困难查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
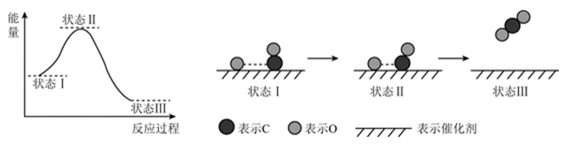
下列说法中正确的是( )
A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒
容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
2NH3(g)
kJ·mol
)
容器
甲
乙
丙
反应物投入量
1mol N2、3mol H2
2mol NH3
4mol NH3
NH3的浓度(mol/L)
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(pa)
p1
p2
p3
反应物转化率
α1
α2
α3
请写出下列物理量的关系:
(1)浓度c1与c2_________________;2c2与c3________________
(2)能量a与b __________________;2b与c___________________
(3)压强p1与p2_________________;2p2与p3__________________
(4)转化率α1与α2________________;α2与α3___________________
难度: 困难查看答案及解析