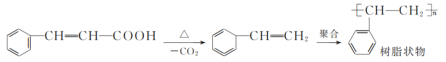
-
化学为人类的生产、生活提供了物质保证。下列工业生产原理不属于化学变化的是( )
A.还原法冶炼生铁 B.分馏法提炼汽油
C.接触法制取硫酸 D.发酵法生产香醋
难度: 简单查看答案及解析
-
过氧乙酸能杀菌消毒,可通过反应CH3COOH+H2O2―→CH3COOOH+H2O制备。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为8的碳原子:68C B.H2O2的电子式:H+[
]2-H+
C.氧原子的结构示意图:
D.过氧乙酸的结构式:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.NH3具有还原性,可用作制冷剂 B.SO2具有氧化性,可用于漂白纸张
C.FeCl3溶液具有酸性,可用于蚀刻铜制品 D.Al(OH)3具有弱碱性,可用作胃酸中和剂
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液:K+、H+、SO42-、MnO4-
B.0.1 mol·L-1 NaClO溶液:Na+、NH4+、CO32-、SO32-
C.0.1 mol·L-1 FeCl3溶液:Ba2+、Al3+、SCN-、Cl-
D.
=0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是( )
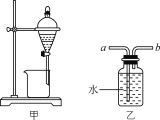
A.用装置甲分液时,两层液体应依次从下口放出
B.用装置乙除去NO中混有的少量NO2时,应将混合气体从a管通入
C.中和滴定时,锥形瓶应先用待测液润洗2~3次
D.配制溶液时加水超过容量瓶的刻度线,应立即用胶头滴管吸出
难度: 中等查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.常温下Cu和浓硫酸反应生成CuSO4
B.过量的Fe与稀硝酸反应生成Fe(NO3)2
C.光照条件下,甲苯和Cl2反应生成邻氯甲苯
D.加热条件下,溴乙烷与NaOH水溶液反应生成乙烯
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大。X的主族序数是其周期数的3倍,Z的最高价氧化物对应水化物呈强碱性,W与X同主族。下列说法正确的是( )
A.原子半径:r(Z)>r(W)>r(X)>r(Y)
B.X的简单气态氢化物的热稳定性比W的弱
C.Y、W的简单阴离子具有相同的电子层结构
D.Z分别与X、Y、W形成的常见化合物均只含离子键
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.Al(s)
Al(OH)3(s)
Al2O3(s)
B.FeS2(s)
SO2(g)
BaSO3(s)
C.Cl2(g)
NaClO(aq)
HClO(aq)
D.Fe(s)
Fe2O3(s)
Fe2(SO4)3(aq)
难度: 简单查看答案及解析
-
如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
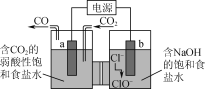
A.a极连接外接电源的负极
B.电解过程中Na+从右池移向左池
C.b极的电极反应式为Cl--2e-+H2O=ClO-+2H+
D.外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
难度: 中等查看答案及解析
-
已知N≡N、N—H、H—H的键能分别为946 kJ·mol-1、391 kJ·mol-1、436 kJ·mol-1。下列说法正确的是( )
A.N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ
B.一定条件下合成氨反应N2+3H2
2NH3达平衡时,3v(H2)正=2v(NH3)逆
C.用液氨和液氧制成的燃料电池放电时可实现将化学能全部转化为电能
D.反应NH3(g)+HCl(g)=NH4Cl(s)常温下能自发进行,该反应的ΔH>0
难度: 中等查看答案及解析
-
根据实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3-
I2+I-)
KI3在CCl4中的溶解度比在水中的大
B
向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜
淀粉未发生水解
C
向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出
Ksp(BaSO4)>Ksp(BaCO3)
D
向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色
氯水具有酸性和漂白性
A.A B.B C.C D.D
难度: 中等查看答案及解析
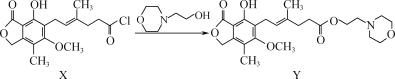
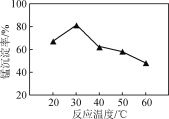
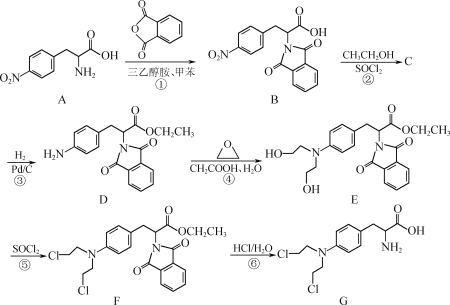
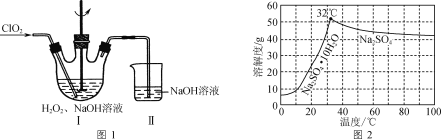
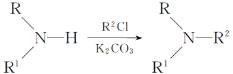 (R、R1代表烃基或H,R2代表烃基)。写出以
(R、R1代表烃基或H,R2代表烃基)。写出以 )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。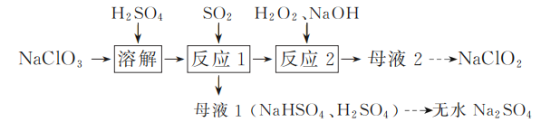
 +CH3COOH
+CH3COOH