-
某元素形成气态氢化物的分子式为HnR,其最高价氧化物对应水化物分子式中有m个氧原子,则其最高价氧化物对应水化物化学式为( )
A.H2m-8+nROm B.H2n-8+mROm C.H2ROm D.H2mROm
难度: 中等查看答案及解析
-
在任何原子里都具有的粒子是( )
A.质子、中子、电子 B.质子、中子 C.质子、电子 D.中子、电子
难度: 简单查看答案及解析
-
下列各分子中所有原子都满足最外层为8电子结构的是( )
A.BF3 B.CCl4 C.SCl6 D.HCl
难度: 中等查看答案及解析
-
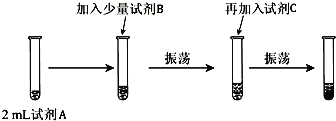
下列化学用语的表述正确的是
A.CSO的电子式:
B.NaClO的电子式:
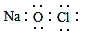
C.CO2的分子示意图:
 D.次氯酸的结构式:H-Cl-O
D.次氯酸的结构式:H-Cl-O难度: 简单查看答案及解析
-
1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列说法正确的是( )
A.其中只含有共价键,是共价化合物 B.其中只含有离子键,是离子化合物
C.其中既有离子键,又有共价键,是离子化合物 D.以上说法都不对
难度: 简单查看答案及解析
-
下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
A.LiI B.NaCl C.MgCl2 D.CaF2
难度: 简单查看答案及解析
-
第五周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )
A.原于半径比铷的原子半径大 B.氯化物难溶于水 C.金属性比镁弱 D.碳酸盐难溶于水
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的最高化合价与最低化合价代数和为2 ,下列说法不正确的是( )
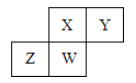
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用,古代有(1)火烧孔雀石炼铜;(2)湿法炼铜;现代有(3)铝热法炼铬;(4)从光卤石(KCl·MgCl2·6H2O)中炼镁。对它们的冶炼方法的分析不正确的是( )
A.(1)用① B.(2)用② C.(3)用③ D.(4)用④
难度: 简单查看答案及解析
-
图甲~丁中关于海带提取碘的部分实验操作及目的正确的是( )
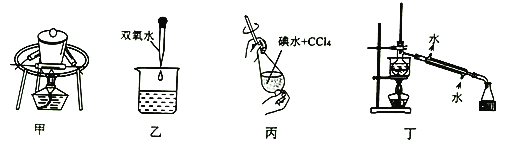
A.装置甲的作用是使海带中I2升华 B.装置乙加H2O2发生置换反应生成I2
C.装置丙用于富集水溶液中的I2 D.装置丁用于分离I2和水的混合物
难度: 简单查看答案及解析
-
下列有关物质结构的说法正确的是( )
A.共价化合物中各原子最外层都一定满足8电子结构
B.BaO2晶体中阳离子与阴离子数目之比为1∶2
C.H2O是一种非常稳定的化合物,这是由于氢键所致
D.在反应2Na2O2+2H2O===4NaOH+O2↑中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成
难度: 中等查看答案及解析
-
下列事实与氢键有关的是:( )
A.水加热到很高的温度都难以分解
B.水结成冰时体积膨胀,密度减小
C.CH4、SiH4、GeH4沸点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 简单查看答案及解析
-
某元素的一种核素X的质量数为A,含N个中子,它与35Cl原子组成XClm分子,则a g XClm中所含质子的物质的量是( )
A.
(A-N+17m) mol
B.
(A-N+17m) mol
C.
(A-N) mol
D.
(A-N) mol
难度: 简单查看答案及解析
-
下列有关叙述:能说明元素M比N的非金属性强的是( )
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子更容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤氧化物对应水化物的酸性HmMOx>HnNOy。
A. ①②③⑤ B. ②⑤ C. ①②③ D. ①②④⑤
难度: 中等查看答案及解析
-
下列各组物质中,化学键类型都相同的是( )
A.HCl与NaOH B.H2S与MgS C.H2O和CO2 D.H2SO4和NaNO3
难度: 中等查看答案及解析
-
以下有关原子结构及元素周期律的叙述正确的是
A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
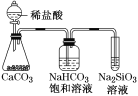
D.用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析