-
下列说法正确的是
A. 需要加热才能发生的化学反应都是吸热反应
B. 应用盖斯定律可以计算某些难以测量的反应焓变
C. 任何能使熵值增大的过程都能自发进行
D. 化学平衡发生移动,平衡常数一定发生变化
难度: 简单查看答案及解析
-
下列各组物质的燃烧热相等的是
A. C2H4和C3H6 B. 1mol碳和3mol碳 C. 白磷和红磷 D. 淀粉和纤维素
难度: 中等查看答案及解析
-
在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·s) B.v(B)=0.3mol/(L·s)
C.v(C)=0.8mol/(L·s) D.v(D)=1mol/(L·s)
难度: 简单查看答案及解析
-
下列有关冰的说法中,正确的组合是 ( )
①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③水结冰时体积膨胀也和氢键有关;
④晶胞与金刚石相似;
⑤与干冰的晶胞相似;
⑥每个水分子平均拥有四个氢键;
⑦冰的结构是由氢键的方向性和饱和性所决定的;
⑧冰中H和O原子之间的作用力不是σ键就是氢键
A.除⑤⑥外 B.除④⑦⑧外 C.除④⑤⑥⑧外 D.全对
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
参照反应Br + H2 →HBr +H的能量对反应历程的示意图,下列叙述中正确的是( )
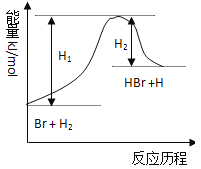
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不改变
C.加入催化剂,该化学反应的活化能不改变
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ①②③ B. ①②③⑤ C. ②⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.高压有利于合成氨的反应
B.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
C.红棕色的NO2,加压后颜色先变深后逐渐变浅
D.黄绿色的氯水光照后颜色变浅
难度: 简单查看答案及解析
-
对于可逆反应2SO2(g)+O2(g)⇌2SO3(g) △H<0,在一定温度下其平衡常数为K,下列说法正确的是( )
A.增大SO2的转化率K值一定增大 B.减小压强K值减小
C.升高温度K值增大 D.K值越大SO2转化率越高
难度: 简单查看答案及解析
-
对于可逆反应:A2(g)+3B2(g)⇌2AB3(g) △H<0。下列图像中正确的是
A.
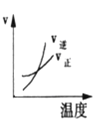 B.
B.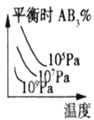 C.
C.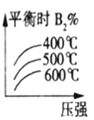 D.
D.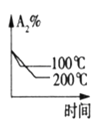
难度: 简单查看答案及解析
-
某温度下,密闭容器中发生反应aX(g)⇌bY(g)+cZ(g),达到平衡后,保持温度不变, 将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原平衡的1.8倍。则下列叙述正确的是
A.平衡向正反应方向移动
B.可逆反应的化学计量数:a>b+c
C.达到新平衡时,Z的质量分数增大
D.达到新平衡时,物质X的转化率减小
难度: 简单查看答案及解析
-
可用下面示意图表示的是
反应
纵坐标
甲
乙
A
SO2与O2在同温、同体积容器中反应
SO2的转化率
2molSO2和1molO2
2molSO2和2molO2
B
2molSO2与1molO2在同温、体积可变的恒压容器中反应
SO2的转化率
1×106Pa
1×105Pa
C
相同质量氨,在同一固定容积容器中反应
氨气的浓度
400℃
500℃
D
体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应
氨气的浓度
活性高的催化剂
活性一般的催化剂
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol
下列结论正确的是( )
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
难度: 简单查看答案及解析
-
在容积一定的密闭容器中,可逆反应:A(g)+B(g)⇌xC(g),符合图(I)所示关系,由此推断对图(II)的说法正确的是
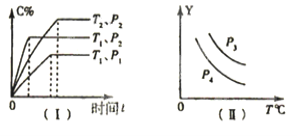
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示C的质量分数
C.P3>P4,Y轴表示混合气体密度
D.P3<P4,Y轴表示混合气体平均摩尔质量
难度: 中等查看答案及解析
-
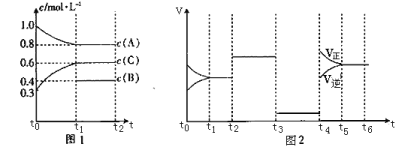
某密闭容器中发生反应:X(g) + 3Y(g)
2Z(g) ΔH < 0。图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所变化,但都没有改变各物质的初始加入量。下列说法正确的是( )
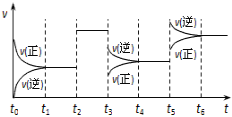
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内反应物转化率最低
难度: 中等查看答案及解析
-
在恒容的密闭容器中充入2molA和1molB的气体后发生反应2A(g)+B(g)⇌xC(g),达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为( )
A.1 或2 B.2 或3 C.3 或4 D.无法确定
难度: 困难查看答案及解析