-
化学与生活、生产密切相关,下列说法正确的是
A.用聚氯乙烯代替木材生产快餐盒,以减少木材的使用
B.中国天眼FAST中用到的碳化硅是一种新型的有机高分子材料
C.港珠澳大桥中用到的低合金钢,具有强度大、密度小、耐腐蚀等性能
D.“司南之杓(注:勺),投之于地,其柢(注:柄)指南。”司南中“杓”所用的材质为FeO
难度: 简单查看答案及解析
-
1,2—二苯乙烯(
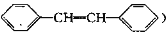 具有抗老年痴呆、抗癌等功能,下列关于该有机物的说法不正确的是
具有抗老年痴呆、抗癌等功能,下列关于该有机物的说法不正确的是A.难溶于水
B.不能使高锰酸钾稀溶液褪色
C.分子中所有原子可能共平面
D.可以发生加成聚合反应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
难度: 中等查看答案及解析
-
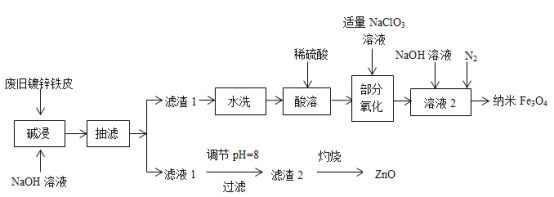
从酸性蚀刻废液(含FeCl2、CuCl2、HCl及少量FeCl3)中回收铜并再生FeCl3酸性溶液的过程中,不涉及的操作是
A.
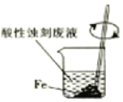 B.
B.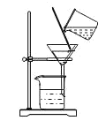
C.
 D.
D.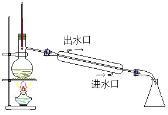
难度: 简单查看答案及解析
-
四种短周期元素X、Y、Z、W(位置如图所示)的原子最外层电子数之和为22,下列说法正确的是
X
Y
Z
W
A.由X、Z形成的二元化合物是一种新型无机非金属材料
B.Z、X、W三种元素氧化物对应水化物的酸性依次增强
C.由X、W和氢三种元素形成的化合物中只含共价键
D.X、Y、W三种元素最简单氢化物的沸点依次升高
难度: 简单查看答案及解析
-
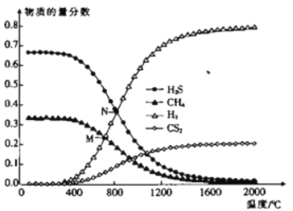
室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
难度: 中等查看答案及解析
-
Persi等人以LiTi2O4作负极,LiFePO4作正极,采用LiClO4-EC-PC-PVdF凝胶作电解质溶液,组成新型锂离子二次电池,电池隔板只允许Li+通过,该锂离子二次电池的结构示意图如图,下列说法不正确的是
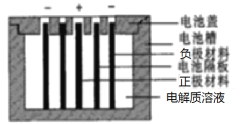
A.若正、负极材料质量相等,当外电路转移1 mol e-时,两极质量差为14g
B.放电时,LiFePO4电极的电势低于LiTi2O4的电势
C.放电时,电解质溶液中的Li+向LiFePO4一极移动
D.充电时,LiFePO4电极接电源的正极,发生氧化反应
难度: 简单查看答案及解析