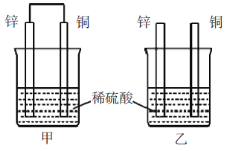
-
2006年俄美两国科学家共同宣布发现了第118号元素,已知第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是
A. 位于周期表的第七周期第ⅣA族 B. 肯定是非金属元素
C. 原子的最外层有4个电子 D. 常见的化合价有+2和+4价
难度: 中等查看答案及解析
-
19世纪中叶,俄国化学家门捷列夫的突出贡献是( )
A.提出原子学说 B.制出第一张元素周期表
C.提出分子学说 D.发现氧气
难度: 简单查看答案及解析
-
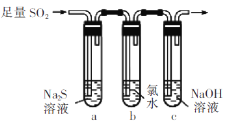
化学与生活生产、可持续发展密切相关。下列说法中正确的是
A.14C可用于文物年代的鉴定,14C和12C互为同素异形体
B.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
C.高纯度的SiO2可以制成光电池,将光能直接转化为电能,
D.Fe2O3是一种红棕色粉末,常用作红色油漆和涂料
难度: 简单查看答案及解析
-
用NaOH固体配制250 mL 1.00 mol/L NaOH溶液时,不必用到的仪器是
A.试管 B.玻璃棒 C.胶头滴管 D.容量瓶
难度: 简单查看答案及解析
-
下列实验装置与实验目的对应的是
A.
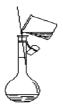 稀释浓硫酸
稀释浓硫酸B.
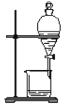 将碘水中的碘单质与水直接分离
将碘水中的碘单质与水直接分离C.
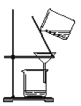 除去Fe(OH)3胶体中的FeCl3
除去Fe(OH)3胶体中的FeCl3D.
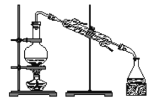 用海水制蒸馏水
用海水制蒸馏水难度: 简单查看答案及解析
-
某些建筑材料中含有放射性元素
Rn(氡),会对人体产生一定危害。该原子的质子数与中子数之和是( )
A.50 B.86 C.136 D.222
难度: 简单查看答案及解析
-
下列化学用语或表达式正确的是
A.二氧化碳的结构式:O-C-O B.S2-的结构示意图:
C.含有10个中子的氧原子的符号:
O D.硫化钠的电子式:
难度: 中等查看答案及解析
-
下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.灼热的炭与CO2反应 B.甲烷与O2的燃烧反应
C.铝与稀盐酸 D.Ba(OH)2·8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
As的原子结构示意图为
,下列关于As的描述不正确的是
A.位于第四周期第VA族 B.酸性:H3AsO4>H3PO4
C.属于非金属元素 D.稳定性:AsH3<PH3
难度: 简单查看答案及解析
-
下列各组物质中,都属于离子化合物的一组是
A.Na2O2 HBr B.Br2 Na2O C.KCl NaOH D.HF H2O
难度: 简单查看答案及解析
-
下列递变规律不正确的是
A.稳定性:PH3>H2S>HCl B.I2、Br2、Cl2氧化性依次增强
C.原子半径:Cl<Mg<Ca D.Na、Mg、Al还原性依次减弱
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是
A.
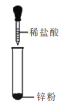 B.
B.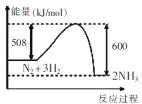 C.
C.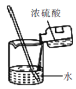 D.
D.
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值,下列有关叙述正确的是
A.标准状况下,2.24L SO3中所含原子数为0.4NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.标准状况下,18 g H2O中所含电子数为10NA
D.将78 g Na2O2与过量CO2反应转移的电子数为2NA
难度: 中等查看答案及解析
-
某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是
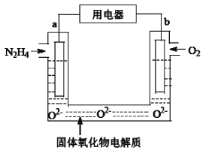
A.b极是正极,发生还原反应
B.电池电路中,电流方向:电极a→用电器→电极b
C.当电极a.上消耗1 mol N2H4时,电极b上被氧化的O2在标准状况下体积为11.2 L
D.b极附近的pH值变大
难度: 中等查看答案及解析
-
下列各图为元素周期表的一部分,表中数字为原子序数,其中X为17的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列实验合理的是
A.
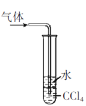 吸收氨气,并防止倒吸
吸收氨气,并防止倒吸B.
 证明非金属性:Cl>C>Si
证明非金属性:Cl>C>SiC.
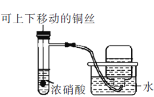 制备并收集少量NO2气体
制备并收集少量NO2气体D.
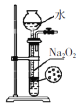 制备少量氧气
制备少量氧气难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.在酸性溶液中:Na+、NO3-、CO32-、K+、
B.能使酚酞试液变红的溶液中:Na+、Cl-、CO32-、SO42-
C.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
D.澄清透明溶液中:K+、Fe3+、SO42-、OH-
难度: 简单查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2=P4O6中消耗3 mol O2放出的热量为
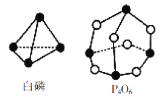
A.1368kJ B.1498kJ C.1638kJ D.1683kJ
难度: 简单查看答案及解析