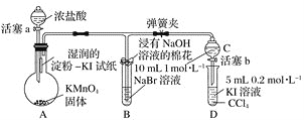
-
A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种元素的离子半径大小顺序是( )
A.A>B>C B.B>A>C C.C>A>B D.C>B>A
难度: 中等查看答案及解析
-
核电荷数小于18的两种元素X、Y,核电荷数:Y>X,两种元素原子的核外电子层数不同,X元素原子的最外层与最内层电子数之比为3∶1,Y元素原子的最外层只有1个电子。下列有关这两种元素形成的化合物的说法不正确的是
A.X、Y形成的两种常见化合物中,每个离子都形成8电子稳定结构
B.X、Y形成的化合物均具有较强的氧化性
C.X、Y形成的两种常见化合物溶解于水所形成的溶液均具有碱性
D.X、Y形成的两种常见化合物中,Y的化合价相同
难度: 简单查看答案及解析
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
难度: 中等查看答案及解析
-
下列有关碱金属单质的性质的说法错误的是( )
A.锂与水反应不如钠与水反应剧烈
B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
难度: 简单查看答案及解析
-
0.05mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A.第三周期ⅠA族 B.第三周期ⅡA族
C.第四周期ⅠA族 D.第四周期ⅡA族
难度: 中等查看答案及解析
-
下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na,故K可以从NaCl溶液中置换出金属钠
C.金属性:K>Na>Li
D.碱金属元素原子最外层电子数相同
难度: 简单查看答案及解析
-
具有下列结构的原子,其元素一定属于ⅡA族的是( )
A.最外层电子数与次外层电子数相等的原子
B.K层电子数为M层电子数一半的原子
C.最外层有2个电子的原子
D.M层电子数等于其内层电子数之和的
的原子
难度: 中等查看答案及解析
-
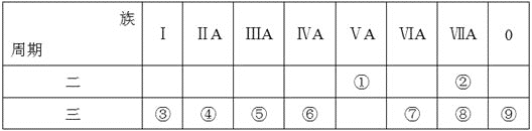
在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为
A.5Z B.5Z+18
C.5Z+10 D.5Z+8
难度: 简单查看答案及解析
-
同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域。下列有关叙述正确的是( )
A.14C与12C是两种不同的元素或核素
B.通过化学变化可以实现16O与18O之间的相互转化
C.35Cl2与37Cl2互为同素异形体
D.铯元素的两种核素中137Cs比133Cs多4个中子
难度: 中等查看答案及解析
-
“神舟七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,则对相同物质的量的这三种物质的下列说法正确的是( )
A.质子数之比为1∶2∶3 B.中子数之比为1∶1∶1
C.摩尔质量之比为8∶9∶10 D.化学性质不相同
难度: 中等查看答案及解析
-
不能说明氧的非金属性比硫强的事实是( )
A.H2O的热稳定性强于H2S
B.H2S水溶液暴露于空气中变浑浊
C.常温下H2O是液体,H2S是气体
D.O2和H2化合比S和H2化合容易
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.
与
得电子能力相同
难度: 简单查看答案及解析
-
X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是
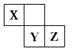
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.Z的气态氢化物比Y的气态氢化物更加稳定
难度: 中等查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )

A.对应的简单离子的半径:X<W
B.对应的简单气态氢化物的稳定性:Y<Z
C.元素X、Z和W能形成多种化合物
D.Y的最高价氧化物对应的水化物具有强酸性
难度: 中等查看答案及解析
-
元素周期表可以指导人们进行规律性的推测和判断,下列说法不正确的是( )
A.若aX2-和bY-的核外电子层结构相同,则原子序数:a=b+3
B.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F
C.锗与硅位于金属与非金属的交界处,都能作半导体材料
D.S和Se分别位于第ⅥA族的第三、四周期,则氢化物的稳定性:H2S>H2Se
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
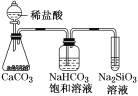
D.用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析