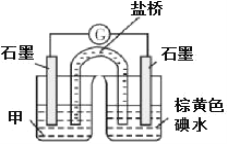
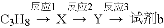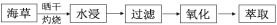-
钼酸钠晶体(Na2MoO4•2H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
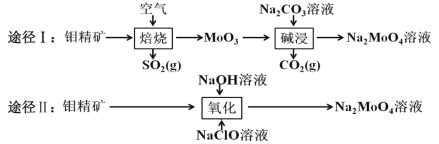
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 mol•L-1,c(CO32-)=0.10 mol•L-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
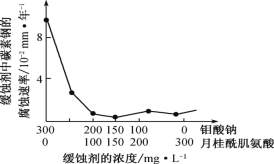
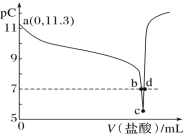
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
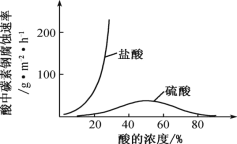
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mg•L-1,则缓蚀效果最好时钼酸钠(M=206 g•mol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
-
党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2 的有效利用可以缓解温室效应,解决能源短缺问题。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4 和 HMCM-22 的表面,以 CO2 为碳源,与电解水产生的 H2 催化转化为高附加值的烃类化合物,其过程如图。
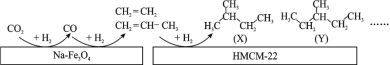
图中 CO2 转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJ•mol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJ•mol-1。图中 CO 转化为 C2H4 的热化学方程式是__________________ 。
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2 合成甲醇,其反应为:CO(g)+2H2(g)⇌CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
| 实验 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) |
| CO | H2 |
| 1 | 0.25 | 0.50 | 0.391 |
| 2 | 0.25 | 1.00 | 0.781 |
| 3 | 0.50 | 0.50 | 0.780 |
该反应速率的通式为 v正=k正 cm(CO)•cn(H2)(k 正是与温度有关的速率常数)。由表中数据可确定反应速率通式中 m =_______、n =_____(取正整数)。实验发现,当实验 1 中 c(H2) = 0.25 mol•L-1时达到平衡,请计算该反应的平衡常数 K = _____。
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
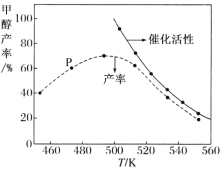
请判断温度为 470 K 时,图中 P 点 _________(填“是”或“不是”)处于平衡状态,490 K 之后,甲醇产率随温度升高而减小的可能原因为:_____、 _____。
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。
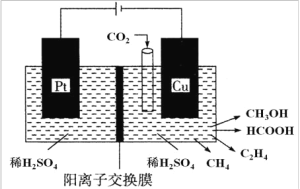
①请写出 Cu 电极上产生 CH3OH 的电极反应式:_____________。
②如果Cu 电极上只生成 0.15 mol C2H4 和 0.30 mol CH3OH,则 Pt 电极上产生O2 的物质的量为 ___________mol。
③已知 HCOOH 为一元弱酸,常温下将 0.1 mol•L-1 HCOOH 溶液与 0.1 mol•L-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=_____________(用含 a、b 的代数式表示)。
-
2018 年 11 月《Nature Energy》报道了中科院大连化学物理研究所科学家用 Ni-BaH2/Al2O3、Ni-LiH 等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,Li、O、H 三种元素的电负性由大到小的顺序为___________;Al 原子核外电子空间运动状态有 8 种,则该原子处于____(填“基态”或“激发态”)。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为 182℃,沸点为 233℃。
①硝酸溶液中 NO3‑的空间构型为__________ 。
②甘氨酸中 N 原子的杂化类型为 ________,分子中σ键与π键的个数比为_________;其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为 141℃)的主要原因:一是甘氨酸能形成内盐,二是______________。
(3)[Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出蓝色沉淀溶解得到深蓝色溶液的离子方程式___________________。
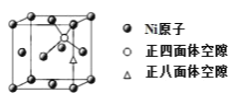
(4)X-射线衍射分析表明,由 Ni 元素形成的化合物 Mg2NiH4 的立方晶胞如图所示,其面心和顶点均被 Ni 原子占据,所有 Mg 原子的 Ni 配位数都相等。则 Mg 原子填入由 Ni 原子形成的 ___空隙中(填“正四面体”或“正八面体”),填隙率是____。
(5)已知 Mg2NiH4 晶体的晶胞参数为 646.5 pm,液氢的密度为0.0708 g•cm-3。若以材料中氢的密度与液氢密度之比定义为储氢材料的储氢能力,在 Mg2NiH4 的储氢能力为____________(列出计算式即可)。
-
“心得安”是质料心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
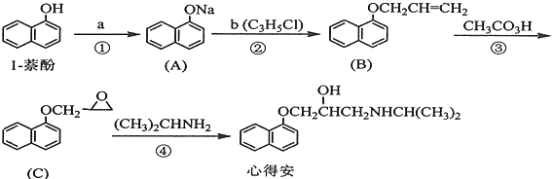
回答下列问题:
(1)试剂a是____________,试剂b的结构简式为______________,b中官能团的名称是_______________。
(2)③的反应类型是____________________。
(3)心得安的分子式为_______________-。
(4)试剂b可由丙烷经三步反应合成:
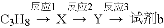
反应1的试剂与条件为_______________,反应2的化学方程式为_______________,反应3的反应类型是_______________。(其他合理答案也可)
(5)芳香化合物D是1-萘(酚)的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4), E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为_______________ ;由F生成一硝化产物的化学方程式为_______________,该产物的名称是_______________。

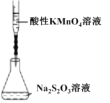

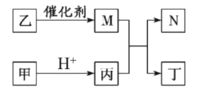
。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:
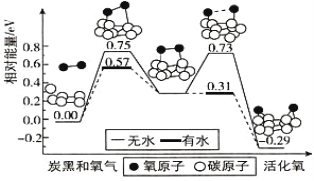
不断减小