-
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的简单气态氢化物水溶液显碱性,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质是黄绿色有毒气体。下列说法正确的是( )
A.Y元素氢化物的稳定性大于Z元素氢化物的稳定性
B.Y、Z、Q简单离子半径由大到小的顺序为Y>Z>Q
C.X、Y、M三种元素形成盐类化合物属于共价化合物
D.X、Z两元素形成的化合物中只含极性共价键
难度: 中等查看答案及解析
-
2022年北京冬奥会速滑比赛将在国家速滑馆举行。运动员比赛用速滑冰刀由不锈钢制成,不锈钢含有的最主要元素是( )
A.铁 B.碳 C.硅 D.铝
难度: 简单查看答案及解析
-
离子和分子是粒子存在的两种重要形式,一些粒子在人的生理活动中发挥着重要的作用。下列常见的粒子中,没有还原性的是( )
A.Cl- B.Na+ C.N2 D.Fe2+
难度: 简单查看答案及解析
-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是( )
A.胶体发生电泳 B.血液中发生氧化还原反应
C.血液中发生复分解反应 D.胶体发生聚沉
难度: 简单查看答案及解析
-
下列各组性质的比较中正确的是
A. 酸性:HI>HBr>HCl B. 碱性:NaOH>KOH>Ca(OH)2
C. 热稳定性:H2O>HF>NH3 D. 还原性:Cl—>Br—>I—
难度: 中等查看答案及解析
-
维护生态平衡,保护环境是关系到人类生存,社会发展的根本性问题。下列气体中,不是大气污染物的是( )
A.CO2 B.SO2 C.NO2 D.NO
难度: 简单查看答案及解析
-
下列说法中正确的一组是( )
A.H2和D2互为同位素
B.
和
是同一种物质
C.正丁烷和异丁烷是同系物
D.
和
互为同分异构体
难度: 简单查看答案及解析
-
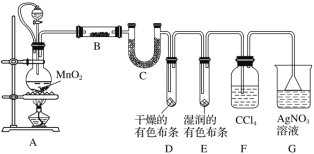
实验室可以按如图所示的装置干燥、贮存气体M,多余的气体可用水吸收,则M是
A. 氯气 B. 氨气 C. 氢气 D. 二氧化氮
难度: 简单查看答案及解析
-
下列装置中,能构成原电池的是

A.只有甲 B.只有乙
C.只有丙 D.除乙均可以
难度: 简单查看答案及解析
-
下列过程中的能量变化与下图一致的是( )
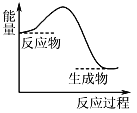
A. 镁条溶于盐酸 B. 氨气液化
C. 碳酸钙分解 D. NaOH固体溶于水
难度: 中等查看答案及解析
-
在C(s)+CO2(g)
2CO(g)反应中可使反应速率增大的措施是( )
①增大压强②增加碳的量③通入CO2④恒压下充入N2⑤恒容下充入N2⑥通入CO
A.①③⑤ B.①③⑥ C.②④⑥ D.③⑤⑥
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数为0.5NA
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤2mol/L的CaCl2溶液中Cl-的数目为4NA
⑥常温常压下,1mol氦气含有的原子数为NA
A.2个 B.3个 C.4个 D.5个
难度: 简单查看答案及解析
-
常温下,下列各组离子因发生氧化还原反应不能大量共存的是( )
A.在含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN-
B.pH=1的溶液中:Fe3+、K+、I-、Cl-
C.能与金属铝反应生成氢气的溶液中:NH4+、Al3+、SO42-、Cl-
D.在强碱溶液中:Na+、K+、Cl-、HCO3-
难度: 简单查看答案及解析
-
某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是( )

A.a棉球褪色,验证SO2具有氧化性
B.c棉球蓝色褪去,验证SO2漂白性
C.b棉球褪色,验证SO2具有酸性氧化物的通性
D.可以使用浓硫酸吸收尾气
难度: 中等查看答案及解析
-
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论错误的是( )
A.向浸取液中滴入硝酸酸化后,加入AgNO3溶液有白色沉淀产生,说明雾霾中一定含有Cl-
B.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+
C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3-
D.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42-
难度: 中等查看答案及解析
-
NO和CO都是汽车尾气里的有害物质,它们能缓缓地反应生成N2和CO2,化学方程式为2NO+2CO
N2+2CO2,对此反应,下列叙述错误的是( )
A. 使用正催化剂能加大反应速率
B. 改变反应物的压强对反应速率产生影响
C. 冬天气温低,反应速率降低,对人体危害更大
D. 无论外界条件怎样改变,均对此化学反应的速率无影响
难度: 中等查看答案及解析
-
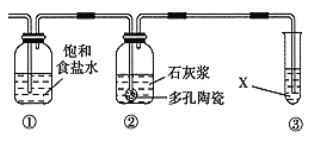
将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
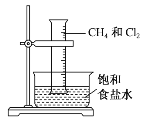
A.该反应的生成物只有四种
B.该反应的条件是光照
C.该反应属于取代反应
D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
难度: 中等查看答案及解析
-
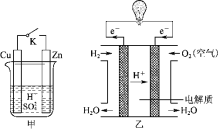
LED产品具有耗电量低、寿命长的特点。下图是氢氧燃料电池驱动LED屏发光的装置,下列有关叙述错误的是( )

A.a处通入的气体是氢气,电极反应式为H2+2OH−-2e−=2H2O
B.装置中电子的流向为a极→N型半导体→P型半导体→b极
C.装置中的能量转化至少涉及三种形式的能量
D.图中
表示来自氢氧燃料电池中的K+的移动方向
难度: 中等查看答案及解析
-
对于可逆反应4NH3+5O2
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.反应达到平衡时,反应物的转化率一定小于100%
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
难度: 中等查看答案及解析
-
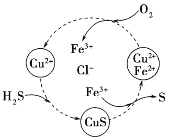
已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )
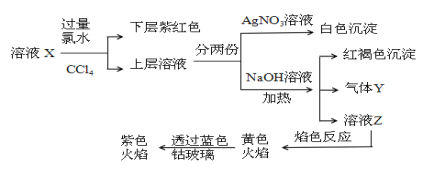
A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
难度: 困难查看答案及解析