-
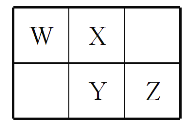
在下列物质中:NaOH、Na2S、(NH4)2S、Na2O2、C2H2、SiC。
(1)其中只含有离子键的离子化合物是__________;
(2)其中只含有极性共价键的共价化合物是__________;
(3)其中既含有离子键又含有非极性共价键的离子化合物是____________;
(4)其中既含有离子键又含有极性共价键的离子化合物是____________;
(5)其中既含有极性键又含有非极性共价键的共价化合物是____________。
难度: 简单查看答案及解析
-
Ⅰ.
U是重要的核工业原料,在自然界的丰度很低。
U的浓缩一直为国际社会关注。回答下列有关问题:
(1)
U的中子数是___。
(2)
U、
U、
U互为同位素,下列对同位素的理解不正确的是___(填序号,下同)。
A.元素符号相同 B.物理性质相同 C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关
U说法不正确的是___。
A.
U原子核内中子数与质子数之差为51
B.
U与
U的质子数、电子数都相等
C.
U与
U是两种质子数相同,中子数不同的原子
D.
U与
U是同种原子
Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2用作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)
Li和
Li用作核反应堆最佳载热体,
LiH和
LiD用作高温堆减速剂。下列说法中正确的是_______(填序号,下同)。
A.
Li和
Li互为同位素 B
Li和
Li属于同种核素
C.
LiH和
LiD的化学性质不同 D.
LiH和
LiD是同种物质
(2)下列说法不正确的是_________。
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
难度: 简单查看答案及解析
-
写出下列物质的电子式或用电子式表示形成过程。
Ⅰ.写出下列物质的电子式
(1)NH4Cl___________
(2)Na2O2___________
Ⅱ.用电子式表示形成过程
(1)CaBr2:_________________
(2)K2O:__________________
(3)CO2:______________
难度: 简单查看答案及解析