-
有下列10 种物质,归类正确的是
①铝②H2S ③金刚石 ④氯水 ⑤NaOH 固体 ⑥BaCO3固体 ⑦氨水 ⑧CO2 ⑨乙醇 ⑩盐酸
A. 能导电的物质①④⑤⑦⑩ B. 含有离子键的化合物: ⑤⑥⑩
C. 电解质: ⑤⑥⑩ D. 共价化合物: ②⑧⑨
难度: 中等查看答案及解析
-
下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与稀盐酸
C.灼热的炭与CO2反应
D.甲烷与O2的燃烧反应
难度: 简单查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。有关原溶液中说法不正确的是( )
A. 至少存在4种离子
B. Cl-一定存在,且c(Cl-)≥0.4mol / L
C. SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在
D. SO42-、NH4+、Fe3+、Cl-一定存在,CO32-一定不存在
难度: 困难查看答案及解析
-
以下说法中不正确的是
A.大气中SO2、NO2随雨水降下可能形成酸雨,酸雨的pH值小于5.6
B.冬天烧煤时可在煤中加入生石灰减少二氧化硫的排放
C.开发清洁能源汽车能减少和控制汽车尾气污染
D.空气质量报告的指标中,有可吸入颗粒物、SO2、NO2、CO2等物质的指数
难度: 简单查看答案及解析
-
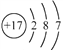
用化学用语表示 NH3+ HCl
NH4Cl中的相关微粒,其中正确的是( )
A. 中子数为8的氮原子:
B. HCl 的电子式:
C. NH3的结构式:
D. Cl−的结构示意图:
难度: 简单查看答案及解析
-
下面是元素周期表的一部分(表中数字和X代表原子序数),其中X为53的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体),在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能,据此,试判断在100kPa下,下列结论正确的是( )
A.石墨比金刚石稳定
B.金刚石比石墨稳定
C.1mol石墨比1mol金刚石总能量高
D.金刚石转化为石墨是物理变化
难度: 中等查看答案及解析
-
下列推测或结论不合理的是( )
A.X2-和Y+核外电子层结构相同,原子序数:X<Y
B.气态氢化物的稳定性HCl>HBr,还原性:Cl->Br-
C.硅、锗都位于金属与非金属元素的交界处,都可以作半导体材料
D.铷(37Rb)和锶(38Sr)分别位于第五周期ⅠA族和ⅡA族,碱性:RbOH>Sr(OH)2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.SiO2 既能和NaOH 溶液反应,又能和氢氟酸反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C.因为2C+SiO2
Si+2CO↑,所以非金属性C>Si
D.晶体硅可用作太阳能电池板或半导体材料,二氧化硅可做光导纤维
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
D.将铜屑加入氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.18 g D2O所含的电子数为10NA
B.1 mol H2O2中含有极性键的数目为3NA
C.标准状况下,22.4 L四氯化碳所含分子数为NA
D.32g O2和O3的混合物中含有的氧原子数为2NA
难度: 中等查看答案及解析
-
如图为实验室中某些气体的制备、除杂、收集装置。用此装置能获得干燥纯净气体的是
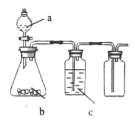
选项
a
b
c
气体
A
浓盐酸
Na2SO3
浓硫酸
SO2
B
稀硝酸
Cu
浓硫酸
NO
C
浓盐酸
MnO2
饱和食盐水
Cl2
D
H2O2
MnO2
浓硫酸
O2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
合成氨及其相关工业中,部分物质间的转化关系如下:
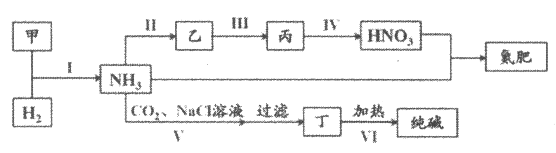
下列说法不正确的是( )
A.甲、乙、丙三种物质都含有氮元素
B.反应II、III和IV的氧化剂一定相同
C.VI的产物可在上述流程中被再次利用
D.丁为NaHCO3
难度: 中等查看答案及解析
-
关于下图的说法不正确的是
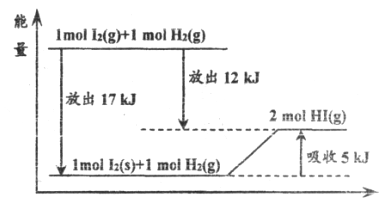
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)气体时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成HI(g)气体的反应是吸热反应
难度: 中等查看答案及解析
-
短周期元素 W、X、Y、Z原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物 WX2,Y原子内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A. WX、WX2、ZX2的化学键类型完全相同
B. WZ2分子中所有原子最外层都满足8电子结构
C. 由于X的常见氢化物(H2X)分子间存在氢键,故H2X比H2Z 稳定
D. 原子半径大小顺序为X<W<Z<Y
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.75 mL C.80 mL D.100 mL
难度: 中等查看答案及解析