-
美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,曾获得诺贝尔化学奖。钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A.
Pd和
Pd的化学性质几乎相同
B.钯与铁是同族元素
C.Pd2+核外有44个电子
D.
Pd的原子核内有52个中子
难度: 简单查看答案及解析
-
反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列化学用语不正确的是( )
A.N2的电子式:
B.NH4Cl的电离方程式:NH4Cl=NH4++Cl-
C.Cl原子的结构示意图:
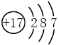
D.H2O的结构式:
难度: 简单查看答案及解析
-
下列现象或事实可用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存
B.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低
C.常温下铁和铂都不溶于浓硝酸
D.不能用pH试纸测定浓硫酸和新制氯水的pH
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.非金属元素的原子间既能形成共价化合物,又能形成离子化合物
B.Cl2、Br2、I2的分子间作用力依次增强
C.氯化氢气体溶于水后电离出离子,是因为破坏了离子键
D.干冰、NaCl固体、石英晶体的熔沸点逐渐升高
难度: 简单查看答案及解析
-
下列排列顺序中,正确的是( )
①热稳定性:H2O>HF>H2S
②离子半径:Cl->Na+>Mg2+>Al3+
③结合质子(H+)能力:OH->CH3COO->Cl-
④酸性:H3PO4>H2SO4>HClO4
⑤还原性:S2->I->Br->Cl-
A.①②③ B.②③④ C.①④⑤ D.②③⑤
难度: 中等查看答案及解析
-
长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是( )
A.LiH、LiD、LiT的摩尔质量之比为1∶2∶3
B.它们和水反应都表现氧化性
C.H、D、T之间互称为同素异形体
D.它们的阴离子半径都比阳离子半径大
难度: 中等查看答案及解析
-
已知某元素的阳离子R+的核内中子数为n,质量数为A。则mg它的氧化物中所含电子的物质的量为( )
A.
(A-n+8)mol B.
(A-n+10)mol
C.
(A-n+4)mol D.
(A-n+8)mol
难度: 简单查看答案及解析
-
已知NA为阿伏加德罗常数的值,下列叙述错误的有几个( )
①BF3、CCl4中所有原子均达到最外层8电子稳定结构
②46g SiO2中含有共价键的数目为NA
③2g H218O和D2O的混合物中,含有的电子数为NA
④K2SO4溶于水的过程中有离子键、共价键的断裂
⑤78g Na2O2中所含离子的数目为4NA
⑥18g D2O的中子数小于10NA
⑦1mol NH5中含有5NA个N—H键(已知NH5中所有原子都达到稀有气体的稳定结构)
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析
-
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是( )
A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高
B.H2O比NH3稳定,则H2S也比NH3稳定
C.Al既能与盐酸反应,又能与氢氧化钠反应,则同主族的铟(In)也都能与二者反应
D.同族元素有Ca(OH)2的碱性强于Mg(OH)2,Pb(OH)4的碱性也应强于Sn(OH)4
难度: 简单查看答案及解析
-
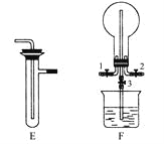
“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”
夹持装置未画出、I2固体易升华
的说法正确的是( )

A.加热时,①中封管内固体消失
B.加热时,②中溶液变为无色,冷却后又变红
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.加热又冷却的过程中,①④属于物理变化,②③属于化学变化
难度: 简单查看答案及解析
-
下列有关物质结构和元素周期律的说法中,正确的是( )
A.共价化合物一定只含有共价键
B.元素原子电子层数越多,越容易失电子,金属性越强
C.同周期元素从左到右,随着原子序数的递增,简单离子的半径逐渐减小
D.同一主族元素对应氢化物的沸点,从上到下逐渐增大
难度: 简单查看答案及解析
-
下列说法正确的个数为( )
①化学键断裂,一定发生化学变化
②任何物质中都存在化学键
③氢键是极弱的化学键
④离子键就是阴、阳离子之间的静电吸引力
⑤活泼金属与活泼非金属化合时能形成离子键
⑥任何共价键中,成键原子成键后均满足稳定结构
⑦验证化合物是否为离子化合物的实验方法是可以看其熔化状态下能否导电
⑧两种非金属元素形成的化合物不可能含有离子键
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
原子序数依次增大的四种短周期元素X、Y、Z、W,X的最高正化合价与Z的相同,Z原子的最外层电子数是内层电子数的0.4倍,Y元素的周期序数等于族序数,W的最高价氧化物对应的水化物的浓溶液Q是实验室常用的气体干燥剂。下列说法错误的是( )
A.W单质易溶于W与X形成的某种化合物
B.X和Z的单质的硬度均较大
C.野外钢轨焊接中常用到Y的单质
D.Q通常可用来干燥CO2、SO2、NO2等气体
难度: 中等查看答案及解析
-
寿山石M4[N4Y10(YX)8]是我国四大印章石之首,被称为国石。X、Y、M、N是原子序数依次增大的短周期元素,M元素是地壳中含量最高的金属元素,N元素的单质常用来制造太阳能电池,X3Y+和YX-含有相同的电子数。下列说法正确的是( )
A.原子半径:X<Y<N<M
B.简单氢化物的稳定性:Y<N
C.第82号元素与M位于同一主族
D.X和M形成的化合物溶于水显酸性
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
Q
原子半径/nm
0.160
0.143
0.102
0.089
0.074
0.078
主要化合价
+2
+3
+6、-2
+2
-2
+5、-3
则下列相关叙述错误的是( )
A.简单氢化物的沸点:T>X
B.离子半径:X2->T2->L2+>M3+
C.T和氢元素形成的化合物中只含有极性共价键
D.M和R的最高价氧化物对应的水化物既能与强碱反应又能与强酸反应
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法不正确的是( )

A.简单离子半径大小:X>Y
B.气态氢化物的还原性:X<Z
C.丁和戊中所含元素种类相同
D.W的简单离子与Z的简单离子在水溶液中可大量共存
难度: 中等查看答案及解析
-
一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )

A.工业上通过电解熔融的WX来制得W
B.Z、X两元素形成的某种化合物可做消毒剂
C.Y的最高价氧化物对应水化物为强酸
D.该漂白剂中各元素均满足8电子稳定结构
难度: 困难查看答案及解析
-
下列实验操作、现象及得出的结论均正确的是( )
选项
实验操作
现象
结论
A
将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液
溶液变红
稀硫酸能氧化Fe2+
B
Cu与浓硫酸反应,实验结束后,将水加入烧瓶中
溶液变蓝
证明反应生成了Cu2+
C
向某溶液中滴加稀硫酸
产生有刺激性气味的气体
原溶液中可能含有SO32-
D
向盛有某溶液的试管中滴加NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某稀溶液中含有5molKNO3和2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A.所得溶液中c(NO3-)=2.75mol·L-1
B.所得溶液中c(Fe2+):c(Fe3+)=1:1
C.反应后生成NO的体积为33.6L(标准状况下)
D.所得溶液中的溶质只有FeSO4
难度: 中等查看答案及解析
-
一定量的浓硝酸与足量铜在烧杯中充分反应,产生NO2、N2O4和NO的混合气体,这些气体若与1.12LO2(标准状况)混合后通入水中,则气体被水完全吸收。若继续向烧杯中加入5mol·L-1H2SO4溶液100mL,剩余的铜恰好被溶解,则Cu的总质量为( )
A.9.6g B.19.2g C.24g D.25.6g
难度: 中等查看答案及解析