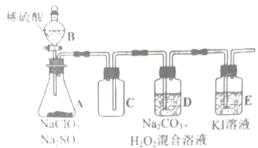
-
中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是
A.雾的分散质粒子直径范围是1~100nm B.淘金原理与化学上的萃取一致
C.沙子的主要成分是
D.“沙中浪底来”指的是金的氧化物
难度: 中等查看答案及解析
-
表示反应2Mg+CO2
2MgO+C中相关微粒的化学用语正确的是
A.镁原子的结构示意图:
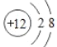 B.二氧化碳分子的比例模型:
B.二氧化碳分子的比例模型:
C.氧化镁的电子式:
D.中子数为8的碳原子:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.木炭具有还原性,可用于冰箱除异味 B.浓硫酸具有脱水性,可用于干燥气体
C.氢氧化铝具有弱碱性,可用于制作胃酸中和剂 D.碳酸氢铵受热易分解,可用作化肥
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液:Na+、Cu2+、NO3-、Cl-
B.
的溶液:K+、Na+、CO32-、NO3-
C.使甲基橙呈红色的溶液:Ba2+、NH4+、Cl-、ClO-
D.能溶解Al(OH)3的溶液:Na+、NH4+、NO3-、CH3COO-
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次递增,X是周期表中非金属最强的元素,W与X同主族,Y、Z是同周期相邻的两种元素,Z元素原子最外层电子数等于周期序数。下列说法正确的是
A.原子半径的大小顺序;
B.简单氢化物的热稳定性:
C.最高价氧化物对应水化物的碱性:
D.工业上,常用电解含Y或Z简单离子溶液的方法冶炼单质Y或Z
难度: 中等查看答案及解析
-
下列制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是
A.制备NH3
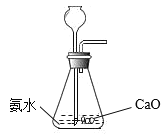 B.干燥NH3
B.干燥NH3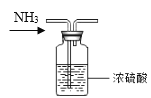
C.收集NH3并验满
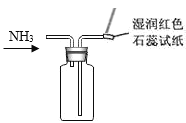 D.尾气处理
D.尾气处理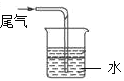
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A.
溶于稀硝酸:
B.酸性溶液中
与
反应生成
C.
与浓盐酸反应制氯气:
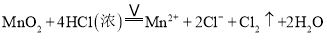
D.向小苏打溶液中滴加少量澄清石灰水:
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.Cu2S(s)
Cu(s)
CuCl2(s)
B.CaCl2(aq)
CaCO3(s)
CaO(s)
C.Fe(s)
Fe2O3(s)
Fe(s)
D.NH3 (g)
NO (g)
HNO3 (aq)
难度: 中等查看答案及解析
-
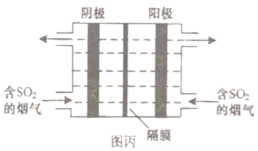
质子膜N2H4燃料电池是一种高效无污染的新型电池(原理示意如图),其反应原理:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-544kJ•mol-1。下列说法正确的是
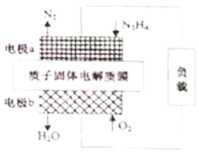
A.电极b上发生氧化反应
B.电极a为原电池正极
C.每32gO2参与反应,电池内部释放544kJ热能
D.电路中每通过1mol电子,有1molH+经质子膜进入正极区
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,则该反应△H<0
B.一定温度下,饱和Ca(OH)2溶液中加入少量的生石灰,所得液的pH会增大
C. CaSO4悬浊液中滴加少量Na2CO3溶液可生成CaCO3,则Ksp(CaCO3) > Ksp(CaSO4)
D.用惰性电极电解1L1mol•L的CuSO4溶液,当阴极析出3.2g铜时,加0.05molCu(OH)2固体可将溶液恢复至原浓度
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
操作和现象
结论
A
向Na2CO3溶液中滴加浓盐酸,反应产生的气体直接通入Na2SiO3溶液中,溶液变浑浊
非金属C>Si
B
向20%蔗糖溶液中加入少量稀硫酸,加热,再加入银铵溶液,未出现银镜
蔗糖未水解
C
将石蜡油蒸气通过炽热的碎瓷片分解,得到的气体通入酸性KMnO4溶液,溶液褪色
分解产物中含乙烯
D
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色
Fe3+的氧化性比I2强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
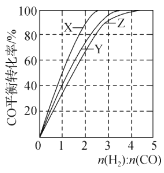
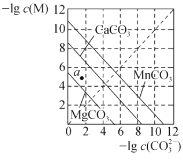
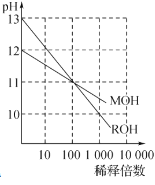
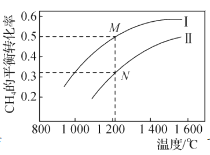
根据下列图示所得出的结论正确的是
A.下图是在不同温度下三个恒容容器中反应2H2(g)+CO(g)⇌CH3OH(g) △H<0的平衡曲线,曲线X对应的温度相对较高
B.下图是一定温度下三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线,a点可表示MgCO3的过饱和溶液,且c(Mg2+)>c(CO32-)
C.下图为MOH和ROH两种一元碱水溶液在常温下分别加水稀释时pH值的变化曲线,可知ROH是强碱
D.下图为两个1L容器中各投入1molCH4和1molCO2所发生反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡曲线,N点化学平衡常数K=1
难度: 中等查看答案及解析
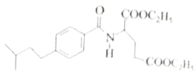
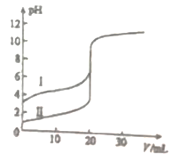

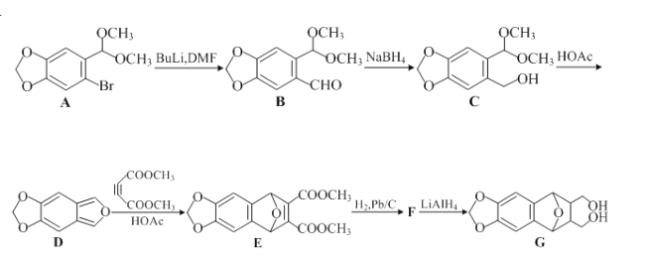
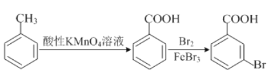 。请以甲苯、BuLi和DMF为原料制备
。请以甲苯、BuLi和DMF为原料制备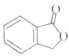 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________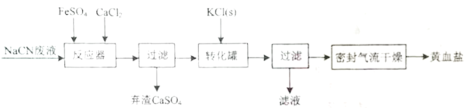
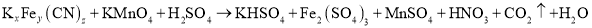 ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。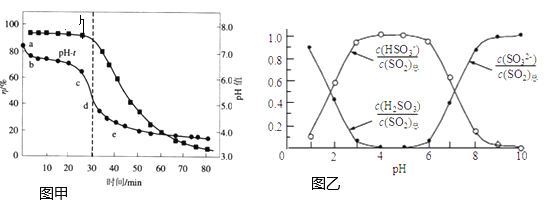
 。
。