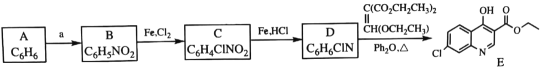
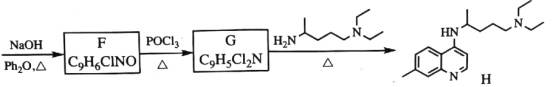
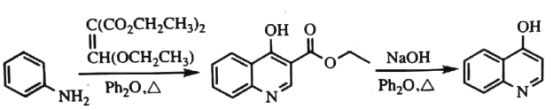
-
近期,我国爆发了新冠状病毒感染导致的肺炎,很多现象可以利用化学知识加以解释。下列过程不涉及化学反应的是
A.使用医用酒精杀死病毒的过程
B.制药厂中合成抗病毒药物达芦那韦的过程
C.患者呼出的病群形成气溶胶的过程
D.病毒在被感染的宿主细胞中的增殖过程
难度: 中等查看答案及解析
-
“我有熔喷布,谁有口罩机”是中国石化为紧急生产医用口罩在网络发布的英雄帖,熔喷布是医用口罩的核心材料,该材料是以石油为原料生产的聚丙烯纤维制成的。下列说法错误的是
A.丙烯分子中所有原子可能共平面
B.工业上,丙烯可由石油催化裂解得到的
C.丙烯可使酸性高锰酸钾溶液褪色
D.聚丙烯是由丙烯通过加聚反应合成的高分子化合物
难度: 简单查看答案及解析
-
X、Y、Z、W 均为短周期元素 , 它们在周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍, 下列说法中正确的是
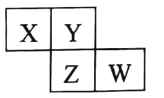
A.最高价氧化物对应水化物的酸性Z比W强
B.只由这四种元素不能组成有机化合物
C.与Z的单质相比较,Y的单质不易与氢气反应
D.X、Y形成的化合物都是无色气体
难度: 中等查看答案及解析
-
利用传感技术测定一定浓度碳酸钠溶液的 pH与温度( T)的关系, 曲线如图,下列分析错误的是
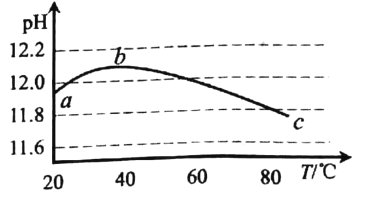
A.碳酸钠水解是吸热反应
B.ab 段说明水解平衡正向移动
C.be 段说明水解平衡逆向移动
D.水的电离平衡也对 pH 产生影响
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1的氨水中含有的NH3 分子数为 0.1 NA
B.标准状况下, 2.24 L 的 CCl4 中含有的 C-Cl 键数为 0.4 NA
C.14 g 由乙烯与环丙烧 ( C3H6) 组成的混合气体含有的碳原子数目为NA
D.常温常压下, Fe 与足量稀盐酸反应生成 2.24 L H2, 转移电子数为0.3NA
难度: 中等查看答案及解析
-
用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的的是
选项
实验目的
仪器
A
用 CCl4 除 去 NaBr 溶液中少量 Br2
烧杯、分液涌斗
B
配制1.0mol•L-1 的H2SO4溶液
量筒、烧杯、玻璃棒、胶头滴管、容量瓶
C
从食盐水中获得NaCl晶体
酒精灯、烧杯、漏斗
D
制备少量乙酸乙酯
试管、酒精灯、导管
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖授予了在锂离子电池领域 作出贡献的三位科学家。他们于 1972年提出“摇椅式“电池 ( Rock ing chair battery), 1980年开发出 LiCoO2材料, 下图是该电池工作原理图,在充放电过程中, Li+在两极之间“摇来摇去”,该电池充电时的总反应为:LiCoO2+ 6C ( 石墨)=Li (1-x)CoO2+LixC6。下列有关说法正确的是

A.充电时,Cu 电极为阳极
B.充电时,Li+将嵌入石墨电极
C.放电时,Al 电极发生氧化反应
D.放电时,负极反应 LiCoO 2—xe-=Li (1-x)CoO2+ (1-x ) + xLi+
难度: 中等查看答案及解析