-
表中关于物质分类的正确组合是
类别
组合酸性氧化物
碱性氧化物
酸
碱
盐
A
CO2
SiO2
H2SO4
Na2CO3
NaHCO3
B
CO
Na2O
HCl
NaOH
NaCl
C
SO2
Na2O2
CH3COOH
KOH
CaF2
D
SO3
CaO
HNO3
Ca(OH)2
CaCO3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. Cl2+2Br-=2Cl-+Br2,Zn+Cu2+=Zn2++Cu均为单质被还原的置换反应
B. 2Na2O2+2H2O=4NaOH+O2↑,Cl2+H2O=HCl+HClO,均为水作还原剂的氧化还原反应
C. Na2SO3与H2O2的反应为氧化还原反应
D. 生石灰用作食品抗氧化剂
难度: 中等查看答案及解析
-
下列过程中,没有发生氧化还原反应的是( )
A. 钻木取火 B. 青铜器生锈 C. 燃放烟花爆竹 D. 利用焰色反应检验Na+
难度: 中等查看答案及解析
-
下列关于铝热反应2Al+Fe2O3
Al2O3+2Fe的说法不正确的是( )
A.该反应中Al作还原剂
B.该反应中氧化产物与还原产物的物质的量比为1∶2
C.该反应中冶炼1 mol Fe转移2 mol电子
D.该反应可用于焊接钢轨
难度: 中等查看答案及解析
-
已知2Fe3++2I-=I2+2Fe2+、2Fe2++Br2=2Br-+2Fe3+。现向含有FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①氧化性:Br2>Fe3+>I2②原溶液中Br-一定被氧化③通入氯气后,原溶液中的Fe2+一定被氧化④不能确定通入氯气后的溶液中是否还存在Fe2+⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A. ①②③④ B. ①③④⑤ C. ②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2转移的电子数为6NA
C.根据反应中HNO3(稀)
NO,而HNO3(浓)
NO2可知,氧化性:HNO3(稀) > HNO3(浓)
D.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A. 物质的溶解过程,实质上就是其电离过程
B. H2SO4溶于水能导电,液态H2SO4不导电,故H2SO4不是电解质
C. 1L 0.1mol·L-1的H2SO4溶液中含有 0.2mol H+
D. 1L 0.1mol·L-1的HClO溶液中含有 0.1mol H+
难度: 简单查看答案及解析
-
水溶液中能大量共存的一组离子是
A. NH4+、Ba2+、Br-、CO32- B. Cl-、SO32-、Fe2+、H+
C. K+、Na+、SO42-、MnO4- D. Na+、H+、NO3-、HCO3-
难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
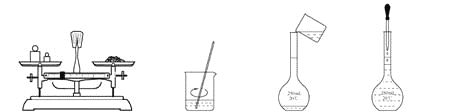
A. 称量 B. 溶解 C. 转移 D. 定容
难度: 中等查看答案及解析
-
取16.8 g碳酸氢钠固体加热一段时间后,剩余固体质量13.7 g,把剩余固体加入到100 mL2 mol/L的稀硫酸中,充分反应后溶液中氢离子的浓度约为
A.1.4 mol/L B.3 mol/L C.0.5 mol/L D.2 mol/L
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA
B.常温下,0.1 mol·L-1NH4NO3溶液中NO3-数目为0.1NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.标准状况下,22.4 L CHCl3含有分子的数目为NA
难度: 中等查看答案及解析
-
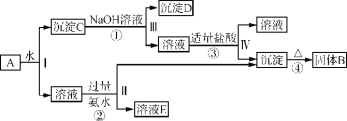
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )

A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析