-
下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1 HNO2溶液的pH=2.1
A. ①②③ B. ②③④ C. ①④ D. ①②④
难度: 中等查看答案及解析
-
有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 中等查看答案及解析
-
以下对影响反应方向因素的判断不正确的是( )
A.有时焓变对反应的方向起决定性作用
B.有时熵变对反应的方向起决定性作用
C.焓变和熵变是判断反应方向的两个主要因素
D.任何情况下,温度都不可能对反应的方向起决定性作用
难度: 简单查看答案及解析
-
将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(OH-)和c(H+)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
难度: 中等查看答案及解析
-
t ℃时,某浓度氯化铵溶液的pH=4,下列说法中一定正确的是( )
A. 由水电离出的氢离子浓度为10-10 mol·L-1
B. 溶液中c(H+)·c(OH-)=1×10-14
C. 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D. 溶液中c(NH3·H2O)+c(NH4+)=c(Cl-)+c(OH-)
难度: 简单查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 中等查看答案及解析
-
在恒温、体积为2L的密闭容器中进行反应:2A(g)
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
A.v(B)=0.03mol·L-1·s-1 B.v(B)=0.045mol·L-1·s-1
C.v(C)=0.03mol·L-1·s-1 D.v(C)=0.06mol·L-1·s-1
难度: 简单查看答案及解析
-
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A. 33% B. 40% C. 50% D. 65%
难度: 中等查看答案及解析
-
在一定温度、不同压强(p1<p2)下,可逆反应:2X(g)
2Y(s)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,其中正确的是( )
A.
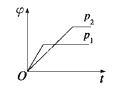 B.
B.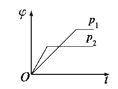
C.
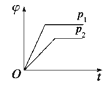 D.
D.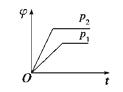
难度: 简单查看答案及解析
-
已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
难度: 简单查看答案及解析
-
下列水解化学方程式或水解离子方程式正确的是( )
A.CH3COOH + NaOH
CH3COONa + H2O B.NH4+ + H2O
NH4OH + H+
C.CH3COO- + H2O
CH3COOH + OH- D.NaCl + H2O
NaOH + HCl
难度: 中等查看答案及解析
-
把1mL0.1mol·L-1的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+,接近于( )
A.1×10-4mol·L-1 B.1×10-8mol·L-1
C.1×10-11mol·L-1 D.1×10-10mol·L-1
难度: 中等查看答案及解析
-
常温下,将甲酸(HCOOH)和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中
A. c(HCOO-) >c(Na+) B. c(HCOO-) <c( Na+)
C. c(HCOO-) =c(Na+) D. 无法确定c(HCOO-) 与c(Na+) 的关系
难度: 中等查看答案及解析
-
温度相同、浓度均为0.2mol·L-1的下列溶液:①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤Na2CO3、⑥CH3COONa,pH由小到大的排列顺序是( )
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.⑤⑥②④①③
难度: 中等查看答案及解析
-
常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D.
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
难度: 中等查看答案及解析
-
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
难度: 简单查看答案及解析
-
某溶液中由水电离出的c(H+)=1×10-11mol/L,该溶液不可能是( )
A. 硫酸氢钠溶液 B. 醋酸钠溶液 C. 氢氧化钠溶液 D. 二氧化硫水溶液
难度: 中等查看答案及解析
-
现有室温下两种溶液,有关叙述正确的是
编号
①
②
pH
12
2
溶液
氢氧化钠溶液
醋酸溶液
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度:c(NaOH)﹥c(CH3COOH)
C.两种溶液等体积混合后:c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D.加水稀释相同倍数后:c(Na+)﹥c(CH3COO-)
难度: 中等查看答案及解析
-
水是最宝贵的资源之一.下列表述正确的是
A.4℃时,纯水的pH=7
B.温度升高,纯水中的c(H+) 增大,c(OH﹣)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
难度: 简单查看答案及解析