-
下列说法正确的是( )
A.SiO2既可以和NaOH溶液反应,也可以和HF溶液反应,所以SiO2是两性氧化物
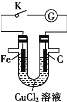
B.向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶
C.石英是良好的半导体材料,可以制成光电池
D.陶瓷的烧制不涉及化学变化
难度: 中等查看答案及解析
-
某些建筑材料含有放射性元素氡22286Rn,会对人体产生一定危害。研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟。该原子的中子数与质子数之和及之差分别是
A. 136,86 B. 50,136
C. 222 , 50 D. 222,86
难度: 简单查看答案及解析
-
已知2H和3H都是制造氢弹的原料。下列关于2H和3H的说法正确的是
A.2H和3H的质子数不同 B.2H和3H互为同位素
C.2H和3H是同一种核素 D.3H原子的电子数为3
难度: 简单查看答案及解析
-
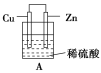
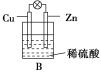
下列各组材料中,不能组成原电池的是 ( )
选项
A
B
C
D
两极材料
锌片、铜片
铜片、银片
锌片、石墨
铁片、铜片
插入溶液
蔗糖溶液
硝酸银溶液
稀硫酸
稀盐酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
A.②③④ B.②④⑥ C.①③⑥ D.①③⑤
难度: 中等查看答案及解析
-
下列根据元素周期律得出的结论正确的是
A.NaOH、Mg(OH)2、Al(OH)3的碱性依次增强 B.HCl、HBr、HI 的稳定性依次增强
C.Na+、Mg2+、Al3+的半径依次增大 D.P、S、Cl 的最高化合价依次升高
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.中子数为20的氯原子:
Cl
B.Mg2+的结构示意图:
C.二氧化碳的电子式:O:: C:: O
D.用电子式表示HCl的形成过程:
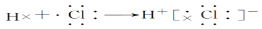
难度: 简单查看答案及解析
-
鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②
Cl2不能长期稳定地存在;③Mg的原子结构示意图为
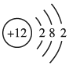 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+A.①②③④ B.仅①②④ C.仅②③④ D.仅①③④
难度: 中等查看答案及解析
-
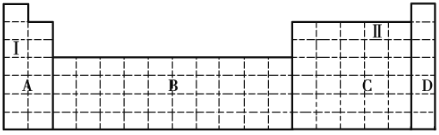
X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.气态氢化物的稳定性:Z>W
D.W的单质能与水反应,生成一种具有漂白性的物质
难度: 中等查看答案及解析
-
酒精燃烧的过程中,发生了能量的转化。下列判断中正确的是
A.化学能部分转化为热能 B.化学能全部转化为热能
C.热能部分转化为化学能 D.光能部分转化为化学能
难度: 简单查看答案及解析
-
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
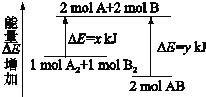
A.该反应是吸热反应
B.断裂1molA-A键和1molB-B键能放出xkJ的能量
C.断裂2molA-B键需要吸收ykJ的能量
D.2molAB的总能量高于1moA2和1molB2的总能量
难度: 中等查看答案及解析
-
一定温度下,当密闭容器中进行的反应:2SO2(g)+O2(g)
2SO3(g)达到平衡时,下列说法不正确的是( )
A.反应已经完全停止 B.SO2的转化率达到最大
C.各物质的浓度不再变化 D.O2的正、逆反应速率相等
难度: 简单查看答案及解析
-
25 ℃ 时,相同的镁条与下列酸溶液反应,反应开始时放出 H2 最快的是
A.20 mL 4 mol·L-1硝酸 B.10mL 1 mol·L-1醋酸
C.10mL 1 mol·L-1硫酸 D.20 mL 1 mol·L-1盐酸
难度: 简单查看答案及解析