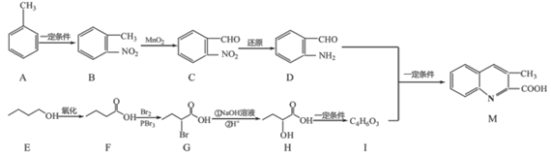
-
化学与生命健康密切相关,“84”消毒液(有效成分为 NaClO)在抗击新冠肺炎疫情中起到重要作用。下列说法错误的是
A.“84”消毒液为混合物
B.“84”消毒液具有漂白性
C.“84”消毒液可用于灭杀新型冠状病毒
D.“84”消毒液可以与“洁厕灵”(主要成分为盐酸)混用
难度: 简单查看答案及解析
-
设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.78 g Na2O2 与足量 CO2 反应,转移电子的数目为NA
B.0.1 mol 聚乙烯含有碳碳双键的数目为 0.1 NA
C.标准状况下,2.24 L H2O 含有电子的数目为NA
D.1 L 0.1 mol/L NaHS 溶液中硫原子的数目小于 0.1 NA
难度: 中等查看答案及解析
-
《Chem.sci.》报道麻生明院士成功合成某种非天然活性化合物(结构如下图)。下列有关该化合物的说法错误的是
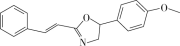
A.分子式为 C18H17NO2
B.能使溴水和酸性高锰酸钾溶液褪色
C.所有氢原子不可能共平面
D.苯环上的一氯代物有 7 种
难度: 中等查看答案及解析
-
下列实验操作能产生对应实验现象的是
实验操作
实验现象
A
用玻璃棒蘸取氯化铵溶液,点在红色石蕊试纸上
试纸变蓝色
B
向盛有 K2Cr2O7 溶液的试管中滴加浓硫酸,充分振荡
溶液由橙黄色逐渐变为黄色
C
向 FeCl3 溶液中加入 KI 溶液,再加入苯,充分振荡,静置
溶液分层,上层呈紫色
D
向蔗糖在硫酸催化下水解后的溶液中,加入新制
氢氧化铜悬浊液并加热
出现砖红色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
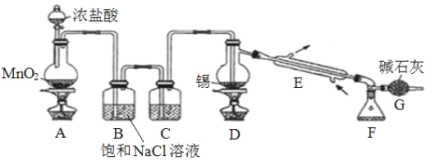
最近我国科学家对“液流电池”的研究取得新进展,一种新型的高比能量锌-碘溴液流电池工作原理如下图所示。下列有关叙述错误的是
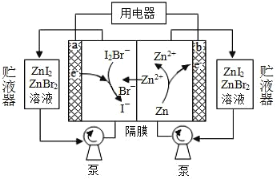
A.放电时,a 极电势高于 b 极
B.充电时,a 极电极反应为 I2Br-+2e-=2I-+Br-
C.图中贮液器可储存电解质溶液,提高电池的容量
D.导线中有 NA 个电子转移,就有 0.5 mol Zn2+通过隔膜
难度: 中等查看答案及解析
-
下图为元素周期表的一部分,X、Y、Z、M 均为短周期元素,除 M 外,其余均为非金属元素。下列说法正确的是
Y
Z
M
X
A.简单离子半径:M>Y B.单质熔点:X>M
C.简单气态氢化物的稳定性:Y>Z D.Y 的氧化物对应水化物均为强酸
难度: 中等查看答案及解析
-
常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与
的变化关系如图所示。下列叙述正确的是
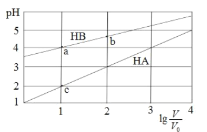
A.pH 随
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
难度: 中等查看答案及解析