-
下列“实验方法”不宜用于完成“实验目的”的是
实验目的
实验方法
A
确认Fe(OH)3胶体是否制备成功
用可见光束照射
B
确认铜与浓硫酸反应生成CuSO4
向反应后混合液中加水
C
确认钠与水反应生成NaOH
向反应后混合液中滴加酚酞
D
确认Cl2无漂白作用
将有色纸条放入干燥Cl2中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活、环境密切相关,下列说法不正确的是
A.竹炭具有超强的吸附能力,可用于吸收新装修房屋内的有害气体
B.溴化银见光易分解,可用于制作感光材料
C.碘酸钾具有较强氧化性,在食盐中加入适量碘酸钾,可抗人体衰老
D.Na2O2吸收CO2产生O2,可用作呼吸面具中的供氧剂
难度: 中等查看答案及解析
-
在自然界中只以化合态存在的元素是
A.C B.N C.S D.Cl
难度: 中等查看答案及解析
-
下列物质长期露置于空气中会变质,但不是发生氧化还原反应的是
A.Na B.Ca(OH) 2 C.Na2SO3 D.氯水
难度: 简单查看答案及解析
-
下列说法不正确的是
A.氯水、氨水、漂白粉都是混合物
B.C60、金刚石、石墨都是碳元素的同素异形体
C.HClO、H2SO4(浓)、HNO3都是强氧化性酸
D.Na2O2、Cl2、SO2都能使紫色石蕊溶液褪色
难度: 中等查看答案及解析
-
如图实验操作正确的是
A.
 给溶液加热 B.
给溶液加热 B. 过滤 C.
过滤 C. 分液 D.
分液 D.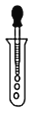 滴加溶液
滴加溶液难度: 中等查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A.Ca2+、Na+、NO3-、ClO- B.NH4+、Na+、HCO3-、OH-
C.H+、K+、MnO4-、S2- D.Mg2+、K+、Cl-、OH-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.NH3的摩尔质量等于NA个氨分子的质量之和
B.标准状况下,22.4L单质溴所含的分子数为NA
C.标准状况下,1mol Cl2与足量Fe完全反应,转移的电子数为3NA
D.常温常压下,48g O2和O3的混合气体含有氧原子数为3NA
难度: 中等查看答案及解析
-
下列关于“1.0 mol·L-1 NaCl溶液”的说法正确的是
A.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B.若取该溶液50 mL,其中c(Cl-) = 0.05 mol·L-1
C.若取该溶液10 mL,恰好能与100 mL 0.1 mol·L-1 AgNO3溶液完全反应
D.该溶液与1.0 mol·L-1 Na2SO4溶液的c(Na+)相等
难度: 中等查看答案及解析
-
下列实验现象的描述不正确的是
A.浓氨水滴入FeSO4溶液中,立即产生红褐色沉淀
B.浓硫酸滴入蔗糖晶体中,蔗糖先变黄后变黑
C.金属钠投入CuSO4溶液中,产生蓝色沉淀
D.将红热铜丝伸入充满氯气的集气瓶中,产生棕黄色的烟
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Cl2通入水中:Cl2 + H2O = 2H+ + Cl- + ClO-
B.FeCl3溶液腐蚀铜箔制印刷线路板:Fe3+ + Cu = Fe2+ + Cu2+
C.H2SO4溶液和Ba(OH)2溶液混合:H+ + SO42- + Ba2+ + OH-= BaSO4↓ + H2O
D.澄清石灰水中通入过量二氧化碳:OH- + CO2 = HCO3-
难度: 中等查看答案及解析
-
同温同压下,质量相同的CO2、H2、NH3三种气体,下列说法错误的是
A.所含分子数由多到少的顺序是:H2>NH3>CO2
B.所含原子数由多到少的顺序是:NH3>CO2>H2
C.所占的体积由大到小的顺序是:H2>NH3>CO2
D.密度由大到小的顺序是:CO2>NH3>H2
难度: 中等查看答案及解析
-
如图为海水综合利用的流程示意图,下列说法错误的是

A.步骤①中加入除杂试剂的顺序可依次是:NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
B.工业上常选用NaOH溶液作为沉淀剂沉淀Mg2+
C.步骤②中生成的Cl2可循环利用
D.步骤③④⑤的目的是为了富集溴
难度: 中等查看答案及解析
-
现有甲、乙、丙、丁四个装置,下列说法不正确的是
A.
 装置甲可作为制取NO2的发生装置
装置甲可作为制取NO2的发生装置B.
 装置乙可作为制取NO的收集装置
装置乙可作为制取NO的收集装置C.
 装置丙可作为制取Cl2的尾气吸收装置
装置丙可作为制取Cl2的尾气吸收装置D.
 装置丁可用于除去NH3中H2O
装置丁可用于除去NH3中H2O难度: 中等查看答案及解析
-
下列物质中含有的杂质(括号内为杂质),不可以用加热的方法除去的是
A.NH4Cl(I2) B.CaO(CaCO3) C.Na2CO3(NaHCO3) D.MgO [Mg(OH)2]
难度: 中等查看答案及解析
-
将气体a通入溶液b中(装置如图所示),始终无明显变化的是

选项
气体a
溶液b
A
CO2
CaCl2
B
Cl2
KI
C
SO2
Ba(NO3)2
D
NO2
FeSO4
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
汽车尾气催化转化装置的工作原理如图所示:

下列说法不正确的是
A.汽车尾气中含有CO、NO,是雾霾成因之一
B.该过程中NO2既是生成物又是反应物
C.该过程中氧元素被还原,氮元素只被氧化
D.该过程中会发生反应:2NO2 + 4CO
4CO2 + N2
难度: 中等查看答案及解析
-
根据下列实验操作和现象,所得结论错误的是
实验操作
现象
结论
A
①滴加足量稀盐酸
②再滴加BaCl2溶液
无明显现象
白色沉淀
原溶液一定含SO42-
B
①滴加稀盐酸
②另取一份滴加CaCl2溶液
有大量气泡产生
白色沉淀
原溶液一定含CO32-
C
①滴加足量浓NaOH溶液,加热
②湿润红色石蕊试纸靠近导管口
产生气体
试纸变蓝
原溶液一定含NH4+
D
①滴加KSCN溶液
②再滴加氯水
无明显现象
溶液呈红色
原溶液一定含Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知氧化性顺序:Cl2>Br2>Fe3+>I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列说法正确的是
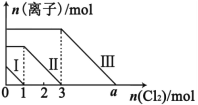
A.线段Ⅰ代表Br-的变化情况
B.线段Ⅲ代表Fe2+的变化情况
C.原混合溶液中n(FeBr2) = 4mol
D.a = 6
难度: 中等查看答案及解析
 B.
B.
 D.
D.

 ②
② ④
④ ⑤
⑤ ⑥
⑥
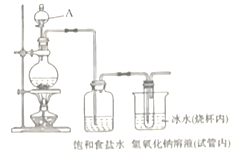
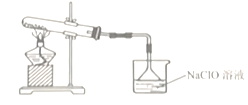
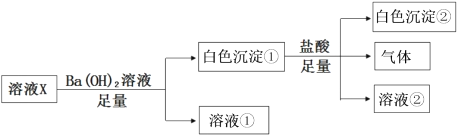
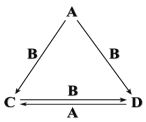

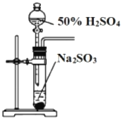 B. 溴水
B. 溴水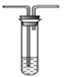 C.氢氧化钠溶液
C.氢氧化钠溶液 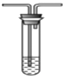 D. 石蕊溶液
D. 石蕊溶液